题目内容
【题目】辉铜矿(主要成分为Cu2S)经火法冶炼,可制得Cu和H2SO4,流程如下图所示:
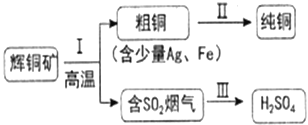
(1)Cu2S中Cu元素的化合价是__________价。
(2)Ⅱ中,电解法精炼粗铜(含少量Ag、Fe),CuSO4溶液做电解质溶液:
①粗铜应与直流电源的_________极(填“正”或“负”)相连。
②铜在阴极析出,而铁以离子形式留在电解质溶液里的原因是__________________________。
(3)Ⅲ中,烟气(主要含SO2、CO2)在较高温度经下图所示方法脱除SO2,并制得H2SO4。
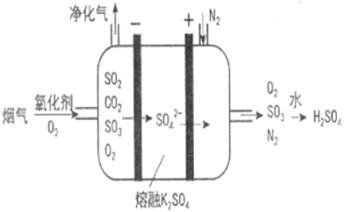
①在阴极放电的物质________________。
②在阳极生成SO3的电极反应式是_______________________________。
(4)检测烟气中SO2脱除率的步骤如下:
(i).将一定量的净化气(不含SO3)通入足量NaOH溶液后,再加入足量溴水。
(ii)加入浓盐酸,加热溶液至无色无气泡,再加入足量BaCl2溶液。
(iii)过滤、洗涤、干燥,称量沉淀质量。
①用离子方程式表示(i)中溴水的主要作用________________________________。
②若沉淀的质量越大,说明SO2的脱除率越________(填“高”或“低”)。
【答案】 +1 正 Cu2+的氧化性大于Fe2+的氧化性 O2 2SO42--4e-= 2SO3↑ + O2 SO32- +Br2+H2O=SO42- +Br- + 2H+ 或SO32-+ Br2+2OH-= SO42-+ 2Br-+ H2O 等 低
【解析】试题(1)Cu2S 中S为-2价,Cu为+1价。
(2)①电解法精炼铜时,粗铜做阳极,精铜做阴极,
②Cu2+比溶液中其他阳离子氧化性更强,浓度更大,在阴极放电,析出铜单质。
(3)①阴极发生还原反应,根据图中所示过程,烟气中O2发生还原反应,
②根据图中所示过程,SO42-放电生成SO3和O2,则阳极的电极反应式是2SO42--4e-=2SO3↑+O2↑。
(4)①溴水将溶液中的SO32-氧化成SO42-,则溴水的主要作用是Br2+SO32-+2OH-= 2Br-+SO42-+ H2O;
②沉淀量越大,说明净化气中硫元素质量分数越大,说明SO2脱除率越低。

 阅读快车系列答案
阅读快车系列答案【题目】一定温度下在甲、乙、丙三个体积相等且恒容的密闭容器中发生反应:NO2(g)+SO2(g) ![]() SO3(g)+NO(g)。投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是
SO3(g)+NO(g)。投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/(mol·L-1) | 0.10 | 0.20 | 0.20 |
c(SO2)/(mol·L-1) | 0.10 | 0.10 | 0.20 |
A. 容器甲中的反应在前2min的平均速率v(NO)=0.05mol·L-1·min-1
B. 容器乙中若起始时改充0.10mol·L-1NO2和0.20mol·L-1SO2,达到平时c(NO)与原平衡相同
C. 达到平衡时,容器丙中SO3的体积分数是容器甲中SO3的体积分数的2倍
D. 达到平衡时,容器乙中NO2的转化率和容器丙中NO2的转化率相同


