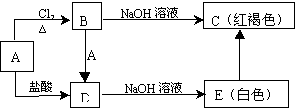
题目内容
12.下列反应的离子方程式正确的是( )| A. | 碳酸钙跟盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 氨水跟盐酸反应:OH-+H+═H2O | |
| C. | 氢氧化钡跟稀硫酸反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 铝与盐酸反应 Al+H+═Al3++H2↑ |
分析 A.碳酸钙为沉淀,应保留化学式;
B.一水合氨为弱电解质,应保留化学式;
C.二者反应生成硫酸钡和水;
D.电荷不守恒.
解答 解:A.碳酸钙跟盐酸反应,离子方程式:CaCO3+2H+═CO2↑+H2O+Ca2+,故A错误;
B.氨水跟盐酸反应,离子方程式:NH3•H2O+H+═H2O+NH4+,故B错误;
C.氢氧化钡跟稀硫酸反应,离子方程式:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故C正确;
D.铝与盐酸反应,离子方程式:2Al+6H+═2Al3++3H2↑,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,离子方程式的书写,为高考高频点,明确物质的溶解性、离子方程式书写规则即可解答,注意离子反应必须遵循客观事实、遵循原子个数、电荷数守恒规律,注意化学式的拆分,题目难度不大.

练习册系列答案
相关题目
3.在强酸性溶液中,下列离子能大量共存的组合为( )
| A. | HCO3-、Ca2+、Ba2+、Na+ | B. | Ca2+、NO3-、Mg2+、SO42- | ||
| C. | Fe3+、Cu2+、NO3-、Cl-C | D. | SO32-、MnO4-、S2-、Na+ |
20.在硫酸铁溶液中,加入a g铜,完全溶解后,又加入b g铁,充分反应后得到c g残余固体,且c<a,则下列判断正确的是( )
| A. | 最后得到的溶液中可能有Fe3+ | B. | 残余固体一定全部是铜 | ||
| C. | 最后得到的溶液中只含Cu2+ | D. | 残余固体可能为铁、铜混合物 |
17.维生素能使Fe3+转变成Fe2+,说明维生素C 具有( )
| A. | 氧化性 | B. | 还原性 | C. | 酸性 | D. | 碱性 |
1.下列有关实验操作、现象和解释或结论都正确的是
( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 某钠盐溶于盐酸,产生气体 | 使澄清石灰水变浑浊 | 说明该钠盐一定是Na2CO3 |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
| C | 等物质的量浓度NaHCO3和Na2CO3与等浓度的稀盐酸反应 | NaHCO3更剧烈 | HCO3-结合H+的能力比CO32-结合H+的能力强 |
| D | 向AlCl3溶液中加放足量的氨水 | 有白色沉淀产生且白色沉淀不消失 | 氨水呈弱碱性 |
| A. | A | B. | B | C. | C | D. | D |
2.已知25°时,乙酸和三氯乙酸的电离常数分别是:Ka(CH3COOH)═1.80×10-5,Ka(CCl3COOH)═0.60,在物质的量浓度均为0.1mol•L-1的CH3COONa和CCl3COONa混合溶液中,下列关系正确的是( )
| A. | c(Na+)═c(CCl3COO-)+c(CH3COO-) | |
| B. | c(CCl3COO-)-c(CH3COO-)═c(CH3COOH)-c(CCl3COOH) | |
| C. | c(OH-)>c(CCl3COO-)>c(CH3COO-) | |
| D. | c(CH3COOH)>c(CCl3COOH)>c(OH-) |
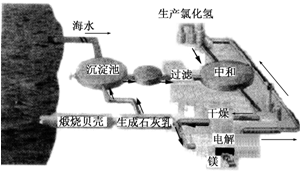 工业上“从海水中提取镁”的流程图如图所示.
工业上“从海水中提取镁”的流程图如图所示.
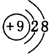 .
.