题目内容
2.砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测.I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) QUOTE 错误!未找到引用源.2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐.
(1)亚砷酸中砷元素的化合价为+3;砷酸的第一步电离方程式为H3AsO4?H++H2AsO4-.
(2)“一级沉砷”中FeSO4的作用是沉淀过量的S2-,使As2S3(s)+3S2-(aq)?2AsS33-(aq)平衡左移,提高沉砷效果;H3AsO3+H2O2=H3AsO4+H2O;
“二级沉砷”中H2O2与含砷物质反应的化学方程式为H3AsO3+H2O2=H3AsO4+H2O.
(3)沉淀X为CaSO4(填化学式).
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10-6g).
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体.
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和As2O3.
步骤3:取1g废渣样品,重复上述实验,未见银镜生成.
(4)AsH3的电子式为
 .
.(5)固体废弃物的排放标准中,砷元素不得高于4.0×10-5g•kg-1,请通过计算说明该排放的废渣中砷元素的含量不符合(填“符合”、“不符合”)排放标准,原因是因为该废渣砷含量为$\frac{3.0×1{0}^{-6}g}{10g}$×1000g/kg=3.0×10-4g/kg,大于排入标准4.0×10-5g•kg-1.
分析 Ⅰ.废水中砷元素主要以亚砷酸(H3AsO3)形式存在,加入硫化钠、硫酸亚铁除去过量的硫离子,过滤得到As2S3和FeS,滤液中加入过氧化氢和氧化钙,H2 O2与含砷物质发生氧化还原反应,氧化亚砷酸为砷酸,过滤得到砷酸铁、砷酸钙、氢氧化铁、沉淀硫酸钙等,
(1)根据化合物中化合价代数和为0计算;砷酸为弱酸,分步电离;
(2)As2 S3与过量的S2一反应,As2S3(s)+3S2-(aq)?2AsS33-(aq),根据化学平衡移动分析FeSO4的作用是沉淀过量的S2-沉砷效果;由流程可知:“二级沉砷”中H2O2与H3AsO3反应生成H3AsO4;
(3)流程分析可知钙离子结合硫酸根离子形成硫酸钙沉淀;
Ⅱ.(4)AsH3和氨气分子结构相同为共价化合物,砷原子和三个氢原子形成三个As-H键;
(5)As的最低检出限为3.0x 10 -6g,取1g废渣样品,重复上述实验,未见银镜生成,取10g废渣样品最后生成银镜和As2 O3.则10g废渣含砷量最少为3.0x 10 -6g,据此分析.
解答 解:Ⅰ.(1)亚砷酸(H3AsO3)中氢元素+1价,氧元素-2价,化合物化合价代数和为0,则砷元素的化合价为+3价,第ⅤA族非金属元素形成最高价含氧酸中磷、砷形成的含氧酸都是弱酸,水溶液中分步电离,电离方程式为:H3AsO4?H++H2AsO4-,
故答案为:+3;H3AsO4?H++H2AsO4-;
(2)“一级沉砷”中FeSO4的作用是除去过量的硫离子,As2S3+3S2-?2AsS32-使平衡逆向进行,提高沉砷效果,“二级沉砷”中H2 O2与含砷物质发生氧化还原反应,氧化亚砷酸为砷酸;,反应的化学方程式为:H2AsO3+H2O2=H3AsO4+H2O,
故答案为:沉淀过量的S2-,使As2S3(s)+3S2-(aq)?2AsS33-(aq)平衡左移,提高沉砷效果;H3AsO3+H2O2=H3AsO4+H2O;
(3)流程分析可知,加入氧化钙和水反应生成氢氧化钙,氢氧化钙和砷酸反应生成砷酸钙沉淀、和铁离子反应生成氢氧化铁沉淀,钙离子结合硫酸根离子形成硫酸钙沉淀,所以沉淀X为CaSO4;
故答案为:CaSO4;
Ⅱ.(4)AsH3和氨气分子结构相同为共价化合物,砷原子和三个氢原子形成三个As-H键,电子式为:
故答案为:
(5)As的最低检出限为3.0x 10 -6g,取1g废渣样品,重复上述实验,未见银镜生成,取10g废渣样品最后生成银镜和As2 O3.则10g废渣含砷量最少为3.0x 10 -6g,则该废渣砷含量为(3.0×10 -6g÷10g)×1000g/kg=3.0×10-4g/kg,大于排入标准4.0×10-5g•kg-1,不符合排放标准;
故答案为:不符合;因为该废渣砷含量为(3.0×10 -6g÷10g)×1000g/kg=3.0×10-4g/kg,大于排入标准4.0×10-5g•kg-1.
点评 本题考查了物质制备方案设计,主要考查了化学方程式的书写、氧化还原反应、环境保护等,注意把握物质性质以及对题目信息的获取于使用,题目难度中等,侧重于考查学生的分析问题和解决问题的能量.

| A. | 2:1:2 | B. | 1:2:1 | C. | 1:1:1 | D. | 2:2:1 |
| A. | H2O | B. | CaO | C. | KOH | D. | NaNO3 |
| A. | 71 g KO2 中所含离子数为 1.806×1024 | |
| B. | 标准状况下,22.4 L 环己烷分子中含 7.224×1024 个 C-H 键 | |
| C. | C2H4 分子中极性键和非极性键的比值为 4:1 | |
| D. | COCl2 和 BF3 分子中所有原子的最外层都达到 8 电子稳定结构 |
| 元素 | 有关性质或结构信息 |
| A | 地壳中含量最多的元素 |
| B | B阳离子与A阴离子电子数相同,且是所在周期中单核离子半径最小的 |
| C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
| D | D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味 |
| E | E与D同周期,且在该周期中原子半径最小 |
| F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
| G | G是形成化合物种类最多的元素 |
 ,用电子式表示C与E形成化合物的过程
,用电子式表示C与E形成化合物的过程 ,D形成的简单离子的结构示意图为
,D形成的简单离子的结构示意图为 .
.(2)F的氢化物是由极性(极性或非极性)键形成的分子,写出实验室制备该氢化物的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)非金属性D小于E(填大于或小于),请从原子结构的角度解释原因:D的原子半径大于E的原子半径,所以得电子的能力比E弱.
| A. | 铁的晶胞中空间利用率为74% | |
| B. | 晶胞中配位数为12的金属,一定是面心立方最密堆积 | |
| C. | Zn的晶胞类型与铜相同 | |
| D. | 简单立方堆积的晶胞中原子配位数是8 |
 3
3
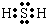 ;
;