题目内容
设NA为阿伏伽德罗常数的值。下列说正确的是
| A.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA |
| B.室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
| C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA |
| D.5NH4NO3△2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA |
D
解析试题分析:A、高温下铁与水蒸气反应的化学方程式为3Fe+4H2O(g)△Fe3O4+4H2,因此高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为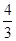 ×0.2 NA=0.27NA,A不正确;B、室温下,1LpH=13的NaOH溶液中,氢离子的物质的量是10-13,水电离出1个氢离子,必然电离出1个OH-离子,所以由水电离的OH-离子数目为10-13NA,B不正确;C、氢氧燃料电池正极消耗氧气,22.4L(标准状况)氧气的物质的量是1mol,氧气在反应中得到4个电子,则1mol氧气得到4mol电子,电路中通过的电子数目为4NA,C不正确;D、5NH4NO3△2HNO3+4N2↑+9H2O反应中,-3价的氮元素升高到0价,失去3个电子。+5价的氮元素降低到0价,得到5个电子,即每生成4mol氮气反应中转移电子的物质的量是15mol。因此生成28g N2即1mol氮气时,转移电子的物质的量是15mol÷4=3.75mol,其的电子数目为3.75NA,D正确,答案选D。
×0.2 NA=0.27NA,A不正确;B、室温下,1LpH=13的NaOH溶液中,氢离子的物质的量是10-13,水电离出1个氢离子,必然电离出1个OH-离子,所以由水电离的OH-离子数目为10-13NA,B不正确;C、氢氧燃料电池正极消耗氧气,22.4L(标准状况)氧气的物质的量是1mol,氧气在反应中得到4个电子,则1mol氧气得到4mol电子,电路中通过的电子数目为4NA,C不正确;D、5NH4NO3△2HNO3+4N2↑+9H2O反应中,-3价的氮元素升高到0价,失去3个电子。+5价的氮元素降低到0价,得到5个电子,即每生成4mol氮气反应中转移电子的物质的量是15mol。因此生成28g N2即1mol氮气时,转移电子的物质的量是15mol÷4=3.75mol,其的电子数目为3.75NA,D正确,答案选D。
考点:考查阿伏伽德罗常数的计算

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列微粒中: 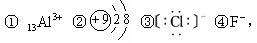
其核外电子数相同的是( )
| A.①②③ | B.②③④ | C.①②④ | D.①③④ |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.常温下,30 g的2-丙醇中含有羟基的数目为0.5 NA |
| B.标准状况下,11.2 L乙炔中含有共用电子对的数目为1.5NA |
| C.1 mol·L-1的碳酸钠溶液中含有CO32-的数目小于NA |
| D.常温下,1 molO2和O3的混合气体中含有氧原子的数目为2.5NA |
设阿伏加德罗常数的值为NA,则下列说法正确的是
| A.标准状况下,11.2L CCl4所含的分子数为0.5NA |
| B.常温常压下,4.2g C2H4和C8H16的混合物中含有的碳原子数为0.3NA |
| C.7.8g苯分子中碳碳双键的数目为0.3 NA |
| D.6.4gCu与20mL10 mol·L-1浓硫酸反应,转移的电子数为0.2NA |
NA为阿伏伽德罗常数的值.下列叙述正确的是
| A.常温常压下,46g的NO2和N2O4混合气体含有的分子数为NA |
| B.1mol Fe粉与1mol水蒸气充分反应转移的电子数为2NA |
C.标准状况下,1L乙醇完全燃烧产生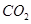 分子的数目为 分子的数目为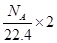 |
D.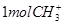 中含有电子数为 中含有电子数为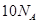 |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,2.24 L NH3分子中共价键数目为0.3 NA |
| B.1 L 1 mol·L-1H2O2溶液中氧原子数目为2 NA |
| C.25℃时,pH=7的纯水中OH-数目为1×10-7 NA |
| D.1 L 0.1 mol·L-1NH4Cl溶液中NH4+数目为0.1 NA |
某种氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数,下列说法正确的是
A.氯元素的相对原子质量是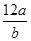 | B.m g该氯原子的物质的量是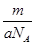 mol mol |
| C.该氯原子的摩尔质量是a NA g/mol | D.a g该氯原子所含质子数是17NA |
设NA为阿伏伽德罗常数,下列说法一定正确的是
| A.4g D2和足量O2反应可生成D2O 2NA个 |
| B.1molNa完全燃烧可转移电子NA个 |
| C.6.02×1023个葡萄糖分子约含羟基6NA个 |
| D.98g H3PO4和H2SO4的混合物中含氢原子2.5NA个 |
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是( )
| A.体积相等时密度相等 | B.原子数相等时具有的中子数相等 |
| C.体积相等时具有的电子数相等 | D.质量相等时具有的质子数相等 |