题目内容
(1)在标准状况下,有下列物质①4gH2,②33.6LCH4, ③1molH2O,④3.01×1023个O2。其
中含分子数最多的是(填序号,下同) ,质量最大的是 ,体积最小的 ;密度由大到小的顺序为 。
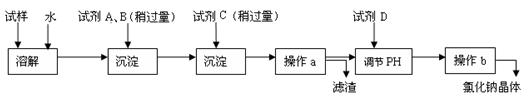
(2)实验室从海藻(含碘元素,以碘离子的形式存在)中提取碘的流程如下:

已知2KI+Cl2=2KCl+I2,步骤④的目的是从含碘的有机溶液中分离出单质碘和回收有机溶液。
I.提取碘的过程中有关的实验操作名称:③ 。
II.有下列实验仪器:A.烧杯 B.玻璃棒 C.表面皿 D.分液漏斗 E.酒精灯
步骤①中必须用到的有(填序号) ,还缺少的玻璃仪器有 。
III.提取碘的过程中,选用的萃取剂可以是 。
A.四氯化碳 B.汽油 C.酒精 D.醋酸
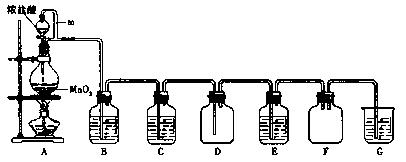
(3)写出实验室制取氯气的化学方程式 。
中含分子数最多的是(填序号,下同) ,质量最大的是 ,体积最小的 ;密度由大到小的顺序为 。
(2)实验室从海藻(含碘元素,以碘离子的形式存在)中提取碘的流程如下:

已知2KI+Cl2=2KCl+I2,步骤④的目的是从含碘的有机溶液中分离出单质碘和回收有机溶液。
I.提取碘的过程中有关的实验操作名称:③ 。
II.有下列实验仪器:A.烧杯 B.玻璃棒 C.表面皿 D.分液漏斗 E.酒精灯
步骤①中必须用到的有(填序号) ,还缺少的玻璃仪器有 。
III.提取碘的过程中,选用的萃取剂可以是 。
A.四氯化碳 B.汽油 C.酒精 D.醋酸
(3)写出实验室制取氯气的化学方程式 。
(1)①、② 、③ ;③④②①
(2)I.萃取; II.A B, 漏斗; III.A B;
(3)MnO2 + 4HCl(浓) MnCl2 + Cl2↑+2H2O
MnCl2 + Cl2↑+2H2O
(2)I.萃取; II.A B, 漏斗; III.A B;
(3)MnO2 + 4HCl(浓)
 MnCl2 + Cl2↑+2H2O
MnCl2 + Cl2↑+2H2O略

练习册系列答案
相关题目

 。
。 b.稀盐酸滴人MnO2中,然后加入NaCl固体,加热
b.稀盐酸滴人MnO2中,然后加入NaCl固体,加热