题目内容
下列离子方程式正确的是
| A.稀硝酸与氢氧化钾溶液反应H++OH-=H2O |
| B.铝与稀盐酸反应Al+2H+=Al3++H2↑ |
| C.三氯化铁溶液与氢氧化钠溶液反应FeCl3+3OH-=Fe(OH)3↓+3Cl- |
| D.二氧化碳与石灰水反应CO2+2OH-=CO32-+H2O |
A
解析试题分析:判断离子方程式正确与否的方法一般是:(1)检查反应能否发生。(2)检查反应物、生成物是否正确。(3)检查各物质拆分是否正确。(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等)。(5)检查是否符合原化学方程式,据此可知A正确;B、没有配平,应该是2Al+6H+=2Al3++3H2↑,B不正确;C、氯化铁应该用离子符号表示,即Fe3++3OH-=Fe(OH)3↓,C不正确;D、二氧化碳与石灰水反应生成碳酸钙沉淀,如果二氧化碳过量则生成碳酸氢钙,D不正确,答案选A。
考点:考查离子方程式的正误判断

练习册系列答案
相关题目
常温下,下列各组微粒在指定的溶液中一定能大量共存的是
| A.c(OH—)=10—13mol·L—1的溶液中:Na+、NH4+、Cl—、NO3— |
| B.1.0 mol·L—1KI溶液中:Mg2+、Fe2+、SO42—、C1O— |
| C.c(Fe3+)="0.1" mol·L-1的溶液中:Na+、NH4+、HCO3-、SCN— |
| D.饱和氨水中:NH4+、Ag+、SO42-、NO3— |
在水溶液中能大量共存的一组离子是( )
| A.Na+、Ba2+、Cl—、NO3— | B.Pb2+、Hg2+、S2—、SO42— |
| C.NH4+、H+、S2O32—、PO43— | D.Ca2+、Al3+、Br—、CO32— |
常温下,下列各组离子在指定溶液中能大量共存的是
| A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ |
B.由水电离的c (H+)="1" ×10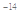 mol/L的溶液中:Ca2+、K+、Cl-、HCO3- mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
| C.c (Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、SCN- |
| D.c (H+)/c (OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- |
下列表示对应化学反应的离子方程式正确的是
A.MnO2固体与浓盐酸反应制取Cl2:MnO2+4HCl Mn2++2Cl-+Cl2↑+2H2O Mn2++2Cl-+Cl2↑+2H2O |
| B.AlCl3溶液中滴加浓氨水至过量:Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
| C.氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
D.NH4HCO3溶于过量的NaOH溶液中:HCO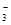 +OH-===CO +OH-===CO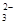 +H2O +H2O |
下列离子方程式中正确的是
A.Cl2通入水中:Cl2+H2O 2H++Cl-+C1O- 2H++Cl-+C1O- |
| B.钢铁发生吸氧腐蚀时,铁作负极:Fe-3e-=Fe3+ |
| C.向双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O |
D.用铜作阳极电解CuSO4溶液:2Cu2++2H2O 2Cu+O2 2Cu+O2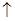 +4H+ +4H+ |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.c(H+)/c(OH-)=1×1014的溶液:Fe2+、K+、HSO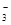 、ClO- 、ClO- |
B.0.1 mol·L-1FeCl3溶液:NH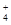 、H+、I-、SCN- 、H+、I-、SCN- |
C.0.1 mol·L-1Na2CO3溶液:K+、Ca2+、HCO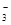 、SO 、SO |
D.使酚酞变红色的溶液:Na+、Ba2+、NO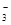 、Cl- 、Cl- |
在无色透明的酸性溶液中,能较大量共存的离子组是( )
| A.MnO4-、K+、SO42-、Na+ | B.Na+、SiO32-、K+、NO3- |
| C.NH4+、NO3-、Al3+、Cl- | D.K+、SO42-、HCO3-、Na+ |
下列反应的离子方程式中,正确的是
| A.NH4HCO3溶液与过量NaOH溶液反应:NH4+ + OH- = NH3·H2O |
| B.在苯酚的乳浊溶液中滴加碳酸钠溶液变澄清:2C6H5OH + CO32- → CO2↑+ 2C6H5O- + H2O |
C.用两根铜棒作电极电解盐酸:2H+ + 2Cl-  H2↑ + Cl2↑ H2↑ + Cl2↑ |
| D.SO2通入次氯酸钠溶液中:SO2 + ClO-+ H2O = SO42- + Cl-+ 2H+ |