题目内容
【题目】学生设计的用氨催化法制取少量HNO3溶液的实验装置如图所示: 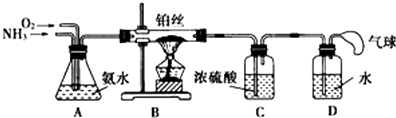
(1)实验室制备NH3 , 下列方法中适宜选用的是(填序号). ①固态氯化铵与熟石灰混合加热 ②固态氯化铵加热分解
③碱石灰中滴加浓氨水 ④氯化铵溶液与氢氧化钠溶液共热
(2)装置B中发生反应的化学方程式为 .
(3)装置C的作用是;装置C中的现象是;为确保装置D中尽可能多地生成HNO3 , 所通入O2和NH3的体积比应大于 .
(4)装置D中发生的反应化学方程式为 .
【答案】
(1)①③
(2)4NH3+5O2 ![]() 4NO+6H2O
4NO+6H2O
(3)吸收未反应的NH3;有气泡从浓硫酸中冒出,且装置C内的上部呈红棕色;2:1
(4)3NO2+H2O═2HNO3+NO
【解析】解:(1)①固态氯化铵与熟石灰混合加热,是实验室制氨气的主要方法,故①正确; ②固态氯化铵加热分解,成氨气和氯化氢,氯化氢和氨气反应生成氯化铵,故②错误;③碱石灰中滴加浓氨水,也是实验室制氨气的方法之一,故③正确;④氯化铵溶液与氢氧化钠溶液共热,氨气易溶于水,能制得氨气但量少,不适合实验室制备氨气,故④错误;故选:①③;(2)氨催化氧化生成一氧化氮和水,方程式为:4NH3+5O2 ![]() 4NO+6H2O;所以答案是:4NH3+5O2
4NO+6H2O;所以答案是:4NH3+5O2 ![]() 4NO+6H2O;(3)装置C浓硫酸的作用是吸收未反应的NH3 , 装置B中产生的NO通过浓硫酸时,可看到浓硫酸中有气泡冒出,同时NO在装置C的上部与O2迅速反应生成红棕色的NO2;为确保装置D中尽可能多地生成HNO3 , 其含义就是NH3通过转化后全部生成HNO3 , 由4NH3+5O2
4NO+6H2O;(3)装置C浓硫酸的作用是吸收未反应的NH3 , 装置B中产生的NO通过浓硫酸时,可看到浓硫酸中有气泡冒出,同时NO在装置C的上部与O2迅速反应生成红棕色的NO2;为确保装置D中尽可能多地生成HNO3 , 其含义就是NH3通过转化后全部生成HNO3 , 由4NH3+5O2 ![]() 4NO+6H2O 及4NO+3O2+2H2O=4HNO3可得:NH3+2O2=HNO3+H2O,由此可见通入O2和NH3的体积比应大于2:1,所以答案是:吸收未反应的NH3;有气泡从浓硫酸中冒出,且装置C内的上部呈红棕色;2:1;(4)NO2与H2O反应,生成硝酸和一氧化氮,方程式为:3NO2+H2O═2HNO3+NO,所以答案是:3NO2+H2O═2HNO3+NO.
4NO+6H2O 及4NO+3O2+2H2O=4HNO3可得:NH3+2O2=HNO3+H2O,由此可见通入O2和NH3的体积比应大于2:1,所以答案是:吸收未反应的NH3;有气泡从浓硫酸中冒出,且装置C内的上部呈红棕色;2:1;(4)NO2与H2O反应,生成硝酸和一氧化氮,方程式为:3NO2+H2O═2HNO3+NO,所以答案是:3NO2+H2O═2HNO3+NO.

【题目】元素周期表的一部分,回答下列问题(用元素符号填写):
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VIIA | O |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)分别写出①、③两种元素形成的高价态化合物的结构式
(2)写出⑨的原子结构示意图 .
(3)在这些元素中,最活泼的金属元素的最高价氧化物对应水化物的电子式 , 其溶于水时破坏的作用力为
(4)这些元素的最高价氧化物的对应水化物中酸性最强;形成的两性氢氧化物的化学式是;上述两者反应的离子方程式
(5)从⑤到的元素中,原子半径最小 .
