题目内容
【题目】请写出下列各题中的离子方程式或化学方程式
(1)碳酸钠与硝酸反应的离子方程式:_________。
(2)二氧化硅与氢氧化钠反应的离子方程式:_____________。
(3)写出工业制硅所涉及的化学方程式:a.__________b.__________c.____________。
(4)写出氢氧化镁与盐酸反应的离子方程式:____________。
(5)请写出一个离子方程式证明溴的氧化性大于碘:_________。
(6)写出一个化学方程式其离子反应为CO32-+2H+=CO2+H2O:______。
(7)写出一种酸在常温下能与硅反应的化学方程式:_______________。
(8)写出用HF雕刻玻璃的化学方程式:_________________。
【答案】CO32-+2H+=CO2↑+H2O SiO2+2OHˉ=SiO32ˉ+H2O SiO2+2C![]() Si+2CO↑ Si(粗)+2Cl2
Si+2CO↑ Si(粗)+2Cl2![]() SiCl4 SiCl4+2H2
SiCl4 SiCl4+2H2![]() Si(纯)+4HCl Mg(OH)2+2H+=Mg2++2H2O Br2+2I-=2Br-+I2 Na2CO3+2HCl=2NaCl+H2O+CO2↑ Si+4HF=SiF4↑+2H2↑ SiO2+4HF=SiF4↑+2H2O
Si(纯)+4HCl Mg(OH)2+2H+=Mg2++2H2O Br2+2I-=2Br-+I2 Na2CO3+2HCl=2NaCl+H2O+CO2↑ Si+4HF=SiF4↑+2H2↑ SiO2+4HF=SiF4↑+2H2O
【解析】
(1)碳酸钠是易溶于水易电离的电解质,硝酸是强酸,在水溶液中全部电离,碳酸钠溶液与硝酸反应生成硝酸钠、水、二氧化碳,离子反应为CO32-+2H+=CO2↑+H2O;答案为:CO32-+2H+=CO2↑+H2O。
(2)二氧化硅是难溶物,在离子方程式保留化学式,二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,反应的离子方程式为:SiO2+2OHˉ=SiO32ˉ+H2O;答案为SiO2+2OHˉ=SiO32ˉ+H2O。
(3)工业上利用二氧化碳与碳在高温下反应生产粗硅,反应的化学方程式为:SiO2+2C ![]() Si+2CO↑,粗硅提纯的方程式为:Si(粗)+2Cl2
Si+2CO↑,粗硅提纯的方程式为:Si(粗)+2Cl2![]() SiCl4;SiCl4+2H2
SiCl4;SiCl4+2H2![]() Si(纯)+4HCl;答案为SiO2+2C
Si(纯)+4HCl;答案为SiO2+2C![]() Si+2CO↑,Si(粗)+2Cl2
Si+2CO↑,Si(粗)+2Cl2![]() SiCl4;SiCl4+2H2
SiCl4;SiCl4+2H2![]() Si(纯)+4HCl。
Si(纯)+4HCl。
(4)氢氧化镁是难溶物,在离子方程式保留化学式,氢氧化镁与稀盐酸反应生成氯化镁和水,离子方程式为Mg(OH)2+2H+=Mg2++2H2O;答案为Mg(OH)2+2H+=Mg2++2H2O。
(5)为验证溴的氧化性强于碘,将溴加入到盛有KI的溶液中,能置换出碘,就可证明,反应的离子方程式为Br2+2I-=2Br-+I2;答案为Br2+2I-=2Br-+I2。
(6)CO32-+2H+=H2O+CO2↑表示可溶性碳酸盐与强酸反应生成可溶性盐和二氧化碳、水的一类反应,如:Na2CO3+2HCl=2NaCl+H2O+CO2↑;答案为Na2CO3+2HCl=2NaCl+H2O+CO2↑。
(7)Si与氢氟酸反应生成氢气和四氟化硅,Si+4HF=SiF4↑+2H2↑;答案为Si+4HF=SiF4↑+2H2↑。
(8)HF雕刻玻璃,其实质是HF与玻璃中的二氧化硅反应生成四氟化硅和水,反应方程式为SiO2+4HF=SiF4↑+2H2O;答案为SiO2+4HF=SiF4↑+2H2O。

【题目】某化学兴趣小组探究铝与稀盐酸反应速率的影响因素,用等质量的铝和等体积、等浓度的足量稀盐酸反应,得到的3组实验数据如下:
实验编号 | 铝的形状 | 反应温度/℃ | 收集100mLH2所需的时间 |
① | 铝粉 | 20 | 21 |
② | 铝片 | 20 | 82 |
③ | 铝片 | 30 | 35 |
回答下列问题:
(1)写出铝与稀盐酸反应的化学方程式______________________。
(2)探究温度对该反应速率影响的对比实验是③和_______ (填实验编号),得出的实验结论是________。
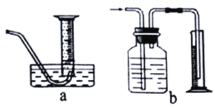
(3)若将该实验中“收集100mL H2所需时间改为“测量相同时间内生成H2的体积”,可选用的排水量气装置为下图中的______________(填装置代号)。