题目内容
4.下列溶液或浊液中,关于离子浓度的说法正确的是( )| A. | 一定浓度的氨水加水稀释的过程中,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的比值减小 | |
| B. | 浓度均为0.1 mol•L-1的Na2CO3、NaHCO3混合溶液中:[c(CO32-)>c(HCO3-),且2c(Na+)═3c(H2CO3)+3c(HCO3-)+3c(CO32-) | |
| C. | 常温下0.4mol/LHB溶液和0.2mol/LNaOH溶液等体积混合后溶液的pH=3,则溶液中微粒浓度存在下面关系:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) | |
| D. | 假设HClO的电离平衡常数为Ka,碳酸的电离常数分别记为:Ka1 和Ka2,已知:Ka1>Ka>Ka2,则发生反应:2NaClO+CO2(少量)+H2O═Na2CO3+2HClO |
分析 A.氨水加水稀释,铵根离子的物质的量增大,一水合氨的物质的量减小;
B.Na2CO3的水解程度大于NaHCO3;
C.常温下0.4mol/LHB溶液和0.2mol/LNaOH溶液等体积混合后溶液的溶质为等物质的量的NaB和HB,溶液的pH=3,说明电离程度大于水解程度;
D.Ka1>Ka>Ka2,说明酸性HClO大于NaHCO3,则NaClO与二氧化碳反应生成NaHCO3.
解答 解:A.氨水加水稀释,铵根离子的物质的量增大,一水合氨的物质的量减小,则$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的比值增大,故A错误;
B.Na2CO3的水解程度大于NaHCO3,则浓度均为0.1 mol•L-1的Na2CO3、NaHCO3混合溶液中c(CO32-)<c(HCO3-),故B错误;
C.常温下0.4mol/LHB溶液和0.2mol/LNaOH溶液等体积混合后溶液的溶质为等物质的量的NaB和HB,溶液的pH=3,说明HB的电离程度大于NaB的水解程度,所以c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-),故C正确;
D.Ka1>Ka>Ka2,说明酸性HClO大于NaHCO3,则NaClO与二氧化碳反应生成NaHCO3,则发生反应:NaClO+CO2(少量)+H2O═NaHCO3+HClO,故D错误.
故选C.
点评 本题考查了弱电解质的电离平衡移动、离子浓度大小比较等,题目涉及的知识点较多,侧重于基础知识的综合应用能力的考查,题目难度中等.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
14.一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+.下列有关说法正确的是( )
| A. | 检测时,电解质溶液中的H+向负极移动 | |
| B. | 若有0.4mol电子转移,则在标准状况下消耗4.48 L氧气 | |
| C. | 电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O | |
| D. | 正极上发生的反应为O2+4e-+2H2O═4OH- |
12.下列说法正确的是( )
| A. | 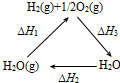 图中△H1=△H2+△H3 | |
| B. | 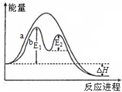 如图在催化剂条件下,反应的活化能等于E1+E2 | |
| C. |  如图表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线 | |
| D. | 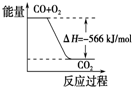 如图可表示由CO(g)生成CO2(g)的过程中要放出566kJ 热量 |
19.下列关于氢键的说法中正确的是( )
| A. | 氢键比分子间作用力强,所以它属于化学键 | |
| B. | 分子内形成的氢键使物质的熔点和沸点升高 | |
| C. | 氨溶于水后氨分子和水分子之间形成了氢键 | |
| D. | 邻羟基苯甲酸的熔点比对羟基苯甲酸的熔点高 |
9.厨房中的化学知识很多,下面是有关厨房中的常见操作或者常见现象,其中发生的变化不属于氧化还原反应的是( )
| A. | 食物久置后,变质腐败产生异味 | |
| B. | 燃烧液化石油气为炒菜提供热量 | |
| C. | 食醋(CH3COOH)除去水瓶里的水垢[主要成分CaCO3和Mg(OH)2] | |
| D. | 烧菜用过的铁锅出现红棕色斑迹 |
16.(1)反应N2O4(g)?2NO2(g);△H>0的平衡体系中,在298K时,平衡常数为K1,在273K时,平衡常数为K2,在373K时平衡常数为K3,K1、K2、K3之间的数量大小关系是K3>K1>K2..
(2)在298K时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
20~40s内用N2O4表示的平均反应速率为0.002mol•L-1•s-1;298K时该反应的平衡转化率=75%;反应进行至100s后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”、“变深”或“不变”);
(3)298K时,反应2NO2(g)?N2O4(g);△H<0达到平衡后,根据下列图象判断引起平衡移动的因素及平衡移动的方向:
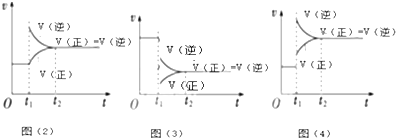
图(2)平衡将向正反应方向移动;图(3)引起平衡移动的因素是减小压强,图(4)引起平衡移动的因素是升高温度.
(2)在298K时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(3)298K时,反应2NO2(g)?N2O4(g);△H<0达到平衡后,根据下列图象判断引起平衡移动的因素及平衡移动的方向:

图(2)平衡将向正反应方向移动;图(3)引起平衡移动的因素是减小压强,图(4)引起平衡移动的因素是升高温度.
13.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法不正确的是( )


| A. | 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 | |
| B. | 相对于途径①、③,途径②更好地体现了绿色化学思想 | |
| C. | 混合气体X不能使品红溶液褪色 | |
| D. | Y可以是葡萄糖 |

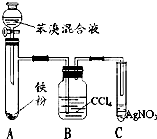 如图是制取溴苯的装置,试回答:
如图是制取溴苯的装置,试回答: