��Ŀ����
��Һ�еĻ�ѧ��Ӧ��������ӷ�Ӧ������Ҫ��ش��������⣮��1���μ�أ����϶�Na2C03��NaCl��������ֲ�����������û�ѧ����ʽ��ʾ�μ�ز������Ե�ԭ��______��ũҵ����ʯ�ཱུ������Եķ�Ӧԭ��______��
��2����֪ˮ��������ƽ�⣺H2O+H2O?H3O++OH-��ˮ�м���NaHSO4���壬ˮ�ĵ���ƽ����______�ƶ�����������Һ��______�ԣ�
��3����ȡpH���������ȵ�NaOH�Ͱ�ˮ�ֱ��ˮϡ��m����nϡ�ͺ�pH����ȣ���m______n���������������=������
��4�������£���pH=6��CH3COOH��CH3COONa�Ļ����Һ��ˮ���������c��OH-��=______��
��5������ͼ����ֽ�ϻ�����0.1000mo1/L NaOH�ζ�20.00m1 0.1000mo1/L HC1�ĵζ�����ʾ��ͼ��
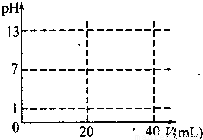
���𰸡���������1����̼����ˮ��Ƕȼ�����ת���Ƕȿ��ǣ�
��2����NaHSO4=Na++H++SO42-���ǣ�
��3��ϡ�ͻ�ٽ�������ʵĵ��룻
��4������Kw����ˮ�����c��OH-����
��5���ҳ������ؼ��㣬��ʼ�㣬ǡ�÷�Ӧ�㼰������ĵ㣬�ѵ�����ƽ�������ɣ�
����⣺��1��̼����ˮ���Լ��ԣ��ʲ�������������������ʯ�࣬���̼���Ʒ�Ӧ����̼��Ƴ�����������̼�������Ũ�ȣ��������������Խ��ͣ��йط���ʽΪ��Na2CO3+H2O?NaHCO3+NaOH��Na2CO3+CaSO4�TCaCO3+Na2SO4���ʴ�Ϊ��Na2CO3+H2O?NaHCO3+NaOH��Na2CO3+CaSO4�TCaCO3+Na2SO4��
��2����2����NaHSO4=Na++H++SO42-���������H+��ʹ��Һ�����ԣ�����ˮ�ĵ��룬�ʴ�Ϊ�������
��3��ϡ�ͻ�ٽ�������ʵĵ��룬����ȡpH���������ȵ�NaOH�Ͱ�ˮ�ֱ��ˮϡ��m����nϡ�ͺ�pH����ȣ���ˮϡ�ͱ����ʴ�Ϊ������
��4��c��OH-��=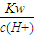 =10-14÷10-6=10-8��mol/L�����ʴ�Ϊ��1×10-8mol/L��
=10-14÷10-6=10-8��mol/L�����ʴ�Ϊ��1×10-8mol/L��
��5���������������Ϊ0ʱ����ҺPHΪ1��������ǡ�÷�Ӧʱ���ü�20mL��PHΪ7���������������ҺPH���������ڼ��PH��=13�����ɴ������ζ����ߣ�
�ʴ�Ϊ��
 ��
��
�����������ۺϿ���������ˮ�⣬ˮ�ĵ��룬������ʵĵ���ƽ�⣬�к͵ζ���֪ʶ�㣮����ƽ���ƶ�ԭ������˳�����⣮����ͼ��Ӧ�ѹؼ��ĵ�����
��2����NaHSO4=Na++H++SO42-���ǣ�
��3��ϡ�ͻ�ٽ�������ʵĵ��룻
��4������Kw����ˮ�����c��OH-����
��5���ҳ������ؼ��㣬��ʼ�㣬ǡ�÷�Ӧ�㼰������ĵ㣬�ѵ�����ƽ�������ɣ�
����⣺��1��̼����ˮ���Լ��ԣ��ʲ�������������������ʯ�࣬���̼���Ʒ�Ӧ����̼��Ƴ�����������̼�������Ũ�ȣ��������������Խ��ͣ��йط���ʽΪ��Na2CO3+H2O?NaHCO3+NaOH��Na2CO3+CaSO4�TCaCO3+Na2SO4���ʴ�Ϊ��Na2CO3+H2O?NaHCO3+NaOH��Na2CO3+CaSO4�TCaCO3+Na2SO4��
��2����2����NaHSO4=Na++H++SO42-���������H+��ʹ��Һ�����ԣ�����ˮ�ĵ��룬�ʴ�Ϊ�������
��3��ϡ�ͻ�ٽ�������ʵĵ��룬����ȡpH���������ȵ�NaOH�Ͱ�ˮ�ֱ��ˮϡ��m����nϡ�ͺ�pH����ȣ���ˮϡ�ͱ����ʴ�Ϊ������
��4��c��OH-��=
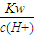 =10-14÷10-6=10-8��mol/L�����ʴ�Ϊ��1×10-8mol/L��
=10-14÷10-6=10-8��mol/L�����ʴ�Ϊ��1×10-8mol/L����5���������������Ϊ0ʱ����ҺPHΪ1��������ǡ�÷�Ӧʱ���ü�20mL��PHΪ7���������������ҺPH���������ڼ��PH��=13�����ɴ������ζ����ߣ�
�ʴ�Ϊ��
 ��
�������������ۺϿ���������ˮ�⣬ˮ�ĵ��룬������ʵĵ���ƽ�⣬�к͵ζ���֪ʶ�㣮����ƽ���ƶ�ԭ������˳�����⣮����ͼ��Ӧ�ѹؼ��ĵ�����

��ϰ��ϵ�д�
 �������Ӳ�ϵ�д�
�������Ӳ�ϵ�д� ���ɿ��õ�Ԫ����AB��ϵ�д�
���ɿ��õ�Ԫ����AB��ϵ�д�
�����Ŀ
 ��2012?�ɶ�ģ�⣩��Һ�еĻ�ѧ��Ӧ��������ӷ�Ӧ������Ҫ��ش��������⣮
��2012?�ɶ�ģ�⣩��Һ�еĻ�ѧ��Ӧ��������ӷ�Ӧ������Ҫ��ش��������⣮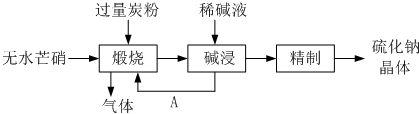
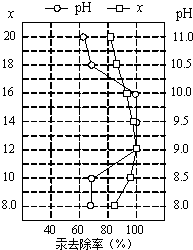 ��4����Ƥ�﹤ҵ��ˮ�еĹ��������Ƴ�ȥ������ȥ��������Һ��pH��x��x�������Ƶ�ʵ�����������������ı�ֵ���йأ���ͼ��ʾ����Ϊʹ����Ч����ѣ�Ӧ���Ƶ�������
��4����Ƥ�﹤ҵ��ˮ�еĹ��������Ƴ�ȥ������ȥ��������Һ��pH��x��x�������Ƶ�ʵ�����������������ı�ֵ���йأ���ͼ��ʾ����Ϊʹ����Ч����ѣ�Ӧ���Ƶ�������