题目内容
|
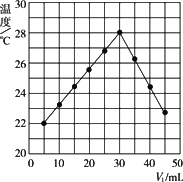
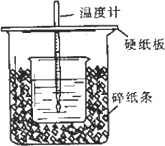
将V1 mL 1.00 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL).下列叙述正确的是
| |
A. |
做该实验时环境温度为22℃ |
B. |
该实验表明化学能可以转化为热能 |
C. |
NaOH溶液的浓度约是1.00 mol·L-1 |
D. |
该实验表明有水生成的反应都是放热反应 |
答案:B
解析:
解析:
|
从表中分析当加入HCl溶液5 mL、NaOH溶液45 mL反应后温度为22℃,故实验时环境温度小于22℃,A项不正确;中和反应为放热反应,B项正确;加入HCl溶液30 mL反应放热最多,应是酸碱正好中和,故c(NaOH)=1.0 mol·L-1·30 mL/20 mL=1.5 mol·L-1,C项不正确;中和反应有水生成,但有水生成的不一定是放热反应,如H2+CuO |

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目