题目内容
(15分)化学是人类进步的关键,化学为人类的生产、生活提供了物质保证。
(1)电镀时,用镀层金属作阳极的作用是 .为了使镀层厚度均匀、光滑致密、与镀件的附着力强,除控制溶液中离子浓度外,通常还可以采取的措施有
(2)卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从卤水中提取镁的步骤为:
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;
d.将MgCl2·6H2O在一定条件下加热得到无水MgCl2;
e.电解熔融的氯化镁可得到Mg。
①步骤d中的“一定条件”指的是 ,目的是 。
②上述提取镁的流程中,为了降低成本.减少污染,可以采取很多措施,请写出其中一点
③有同学认为:步骤b后可加热Mg(0H)2得到Mg0,再电解熔融的MgO制金属镁,这样可简化实验步骤,你同意该同学的想法吗?为什么?
。
(3)铀是核反应最重要的燃料,已经研制成功一种螫合型离子交换树脂,它专门吸附海水中的U4+,而不吸附其他元素。其反应原理为 (树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理 为 。
(4)阿司匹林( )在潮湿空气中可分解成水杨酸和醋酸而略带酸臭味,故密封保存,用化学方程式表示阿司匹林必须贮藏于密闭、干燥处的原因: ,此反应的类型属于 。
)在潮湿空气中可分解成水杨酸和醋酸而略带酸臭味,故密封保存,用化学方程式表示阿司匹林必须贮藏于密闭、干燥处的原因: ,此反应的类型属于 。
(1)镀层金属在阳极失去电子,及时补充溶液中的离子,使溶液中离子浓度保持不变,从而使电镀的速度保持不变,使镀层厚度均匀 (2分)适当降低电镀时直流电源的电压、在电镀液中加入少量的表面活性剂(2分)
(2)①在HCl气流中(1分) 抑制MgCl2水解(1分) ②电解产生的C12用于制取HCl气体(1分)
③不同意,因为MgO熔点很高,熔融时因耗费大量的能量而增加生产成本(3分)
(3)4HR+U4+=UR4+4H+(1分) UR4+4H+=4HR+U4+(1分)
(4)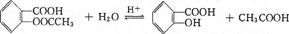 (2分) 水解反应(或取代反应)(1分)
(2分) 水解反应(或取代反应)(1分)
解析

(化学与技术,15分)微生物对人类有着各种各样的用途,现在生物工程学家利用微生物从矿石中提取金属。铜是一种很有价值的金属,可以从铜矿中提取。微生物法是采用某些细菌能用空气中的氧气氧化硫化铜矿石,把不溶性的硫化铜转化成可溶的硫酸铜。利用细菌提取铜的生产过程:在已有细菌存在的岩石、矿石堆中,喷洒酸水以促进细菌生长;在它们的生长过程中,氧化而成的硫酸铜形成低浓度的溶液流到矿石堆的底部,再从这种溶液中提取金属铜。水循环使用,再回到矿石堆中。在美国,10%的铜是用这种方法生产的。
试回答下列问题:
(1)细菌把硫化铜氧化为硫酸铜的过程中起了什么作用:
(2)从硫酸铜溶液中提取铜,简便而经济的方法是 ;相应的化学方程式为: 。
(3)普通生产铜的方法是在空气中燃烧硫化铜(产物中有一种气态氧化物)。试比较两种方法的优缺点。
(4)用一定量的铁与足量的稀H2SO4及足量的CuO制成单质铜,有人设计以下两种方案:①FeH2Cu ②CuOCuSO4Cu
若按实验原则进行操作,则两者制得单质铜的量的比较中,正确的是 ( )
| A.①多 | B.②多 | C.相等 | D.无法判断 |
(6)工业上制备氯化铜时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO+2HCl===CuCl2+H2O FeO+2HCl===FeCl2+H2O
已知:pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完 全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可以采用的方法是

 )在潮湿空气中可分解成水杨酸和醋酸而略带酸臭味,故密封保存,用化学方程式表示阿司匹林必须贮藏于密闭、干燥处的原因:
,此反应的类型属于
。
)在潮湿空气中可分解成水杨酸和醋酸而略带酸臭味,故密封保存,用化学方程式表示阿司匹林必须贮藏于密闭、干燥处的原因:
,此反应的类型属于
。