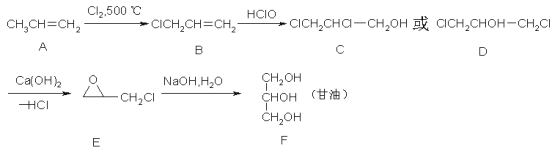
题目内容
【题目】有BaCl2和NaCl的混合溶液aL,将它均分成两份,一份滴加稀硫酸,使Ba2+完全沉淀,另一份滴加AgNO3,使Cl-完全沉淀,反应中消耗xmol H2SO4、ymol AgNO3。据此得知原溶液中c(Na+)/mol·L -1为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
【答案】D
【解析】
由BaCl2和稀硫酸反应可计算Ba2+离子的物质的量,利用NaCl和AgNO3溶液反应计算出Cl-离子的物质的量,由混合液呈电中性可计算出钠离子的物质的量,并注意均分成两份及计算原混合溶液中的c(Na+)来解答即可。
由离子方程式反应Ba2++SO42-=BaSO4↓可知每一等份溶液中的Ba2+离子的物质的量为xmol,根据反应Cl-+Ag+=AgCl↓可知每一等份溶液中Cl-离子的物质的量为ymol, 根据溶液显中性可知:BaCl2和NaCl的混合溶液不显电性,每一份溶液的Na+的物质的量n(Na+)=(y-2x)mol,则原溶液中的钠离子为:n(Na+)总=2(y-2x)mol=(2y-4x)mol,因此原溶液中的钠离子浓度为:c(Na+)=![]() mol/L,故合理选项是D。
mol/L,故合理选项是D。

练习册系列答案
相关题目