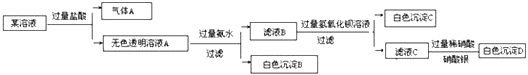
题目内容
【题目】甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.0kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) △H =-129.0kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为______________。
(2)将1.0molCH4和2.0molH2O(g)通入容积为100 L的反应室,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如下图。
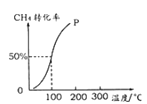
假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为_______。
(3)在压强为0.1MPa、温度为300℃条件下,将amolCO与3amol H2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的![]() ,其他条件不变,对平衡体系产生的影响是__________(填字母序号)。
,其他条件不变,对平衡体系产生的影响是__________(填字母序号)。
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡![]() 减小 E.平衡常数K增大
减小 E.平衡常数K增大
(4)1mol甲醇完全燃烧产生气体通入1L1.5mol/L的NaOH溶液反应,反应后的溶液中各离子浓度大小关系为____________________。
【答案】 CH4(g)+H2O(g)=CH3OH(g)+H2(g) ΔH=+77kJ·mol-1 3×10-3 C D c (Na+) >c (HCO3-) > (CO32-) >c (OH- ) > (H+)
【解析】(1).Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.0kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) △H =-129.0kJ·mol-1
依据盖斯定律Ⅰ+Ⅱ得到CH4(g)+H2O(g)=CH3OH(g)+H2(g) ΔH=+77kJ·mol-1,故答案为:CH4(g)+H2O(g)=CH3OH(g)+H2(g) ΔH=+77kJ·mol-1;
(2).将1.0mol CH4和2.0mol H2O(g)通入容积固定为100L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率= =3×10-3 molL-1min-1,故答案为:3×10-3 molL-1min-1;
=3×10-3 molL-1min-1,故答案为:3×10-3 molL-1min-1;
(3). A.平衡后将容器的容积压缩到原来的![]() ,压强增大,平衡向正反应方向移动,生成物的浓度增大,由于平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大,故A错误;
,压强增大,平衡向正反应方向移动,生成物的浓度增大,由于平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大,故A错误;
B. 压强增大,正逆反应速率都增大,但正反应速率增大更多,故B错误;
C. 压强增大,平衡向正反应方向移动,CH3OH的物质的量增加,故C正确;
D. 压强增大,平衡向正反应方向移动,氢气的物质的量减小,甲醇的物质的量增大,故重新平衡时![]() 减小,故D正确;
减小,故D正确;
E. 平衡常数只受温度影响,温度不变,平衡常数不变,故E错误;
故答案为C D;
(4).1mol甲醇完全燃烧产生气体n (CO2)=1mol,1L、1.5molL-1的NaOH溶液中n(NaOH)=C×V=1.5mol,则有:2>![]() =
= ![]() >1,则反应的可能方程式有:CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,所以:所得产物为Na2CO3和NaHCO3,设所得产物中含Na2CO3为xmol,NaHCO3为ymol,则得方程组:
>1,则反应的可能方程式有:CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,所以:所得产物为Na2CO3和NaHCO3,设所得产物中含Na2CO3为xmol,NaHCO3为ymol,则得方程组:
x + y = 1 ,2x + y = 1.5,解得:x=0.5,y=0.5,在含等物质的量的碳酸钠、碳酸氢钠的溶液中,c(Na+)最大,碳酸根离子水解大于碳酸氢根离子的水解,则c(HCO3-)>c(CO32-),水解使溶液显碱性,则c(OH-)>c(H+),显性离子大于隐性离子,所以c(HCO3-)>c(CO32-)>c(OH-)>c(H+),即离子浓度大小为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。