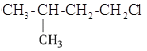题目内容
【题目】元素A和元素B的原子序数都小于18,已知A原子的最外层电子数为a,次外层电子数为b,B原子的M层电子数为![]() ,且
,且![]() ,
,![]() 层电子数为a+b,则下列叙述不正确的是( )
层电子数为a+b,则下列叙述不正确的是( )
A.![]() 元素位于元素周期表中第3周期ⅣA族
元素位于元素周期表中第3周期ⅣA族
B.![]() 、
、![]() 两元素可形成化合物
两元素可形成化合物![]()
C.![]() 、
、![]() 两元素所形成的化合物能与碳反应
两元素所形成的化合物能与碳反应
D.![]() 、
、![]() 两元素所形成的化合物既能与氢氧化钠溶液反应又能与盐酸反应
两元素所形成的化合物既能与氢氧化钠溶液反应又能与盐酸反应
【答案】D
【解析】
元素A和B的原子序数都小于18,B元素原子的M层电子数为(a-b),L层电子数为(a+b),则a+b=8,A元素原子最外层电子数为a,次外层电子数为b,则A元素的次外层为K层,即b=2,有2个电子层,所以a=8-2=6,故A为氧元素,B为的M层电子数为6-2=4,故B为硅元素,据此解答。
A.B为硅元素,位于周期表中的第三周期、第ⅣA族,故A不符合题意;
B.A、B两元素所形成的化合物为SiO2,属于原子晶体,原子通过共价键形成,故B不符合题意;
C.SiO2能与碳在高温下反应,生成硅与CO,故C不符合题意;
D.SiO2能与氢氧化钠反应,生成硅酸钠与水,不能与盐酸反应,故D符合题意;
故选D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目