题目内容
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,旧键断裂,新键形成必然有能量变化.已知拆开1molH﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘反应生成2mol HI需要_______(填“放出”或“吸收”)_______kJ的热量.
(2)在生产和生活中经常遇到化学能与电能的相互转化.
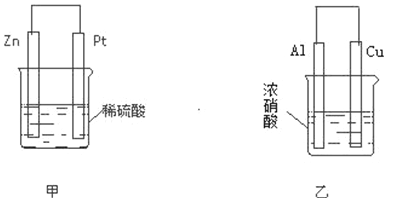
在如图甲、乙两装置中,甲中负极电极反应式为__________________,溶液中的阴离子向______极移动(填“Zn”或“Pt”);乙中铜电极作_______极,发生_______反应(填“氧化”或“还原”).
【答案】 放出 11 Zn﹣2e﹣=Zn2+ Zn 负 氧化.
【解析】(1)从能量的角度看,断开化学键要吸收能量,而形成化学键要放出能量,因此反应热就是断键吸收的能量和形成化学键所放出的能量的差值。所以以生成1molHI的反应热是436 kJ/mol+151 kJ/mol-2×299 kJ/mol=-5.5kJ/mol,即生成2mol HI需要放出的热量是5.5kJ/mol×2mol=11mol;(2)原电池中较活泼的金属是负极,失去电子,发生氧化反应,其电极反应式为:Zn﹣2e﹣=Zn2+;原电池中阴离子向负极移动,即向Zn电极移动;乙中铝的金属性强于铜的,但常温下铝被浓硝酸钝化产生氧化铝,能和浓硝酸继续反应的是铜,所以铜是负极,铝是正极,铜失去电子作为负极发生氧化反应。

练习册系列答案
相关题目