题目内容
2.将足量澄清石灰水加入到250mL的碳酸钠溶液中,过滤低温干燥后得到10克沉淀.求次碳酸钠溶液的物质的量浓度.分析 将足量澄清石灰水加入到250mL的碳酸钠溶液中,发生反应:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,10g沉淀为碳酸钙,根据方程式计算碳酸钠的物质的量,再根据c=$\frac{n}{V}$计算.
解答 解:令碳酸钠的物质的量为x mol,则:
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
1mol 100g
xmol 10g
1mol:xmol=100g:10g
解得x=0.1,
故碳酸钠的物质的量浓度=$\frac{0.1mol}{0.25L}$=0.4mol/L,
答:碳酸钠的物质的量浓度为0.4mol/L.
点评 本题考查化学方程式的有关计算,比较基础,侧重对基础知识的巩固,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
12.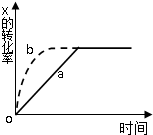 右图曲线a表示放热反应 2X(g)+Y(g)?2Z(g) 进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
右图曲线a表示放热反应 2X(g)+Y(g)?2Z(g) 进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
 右图曲线a表示放热反应 2X(g)+Y(g)?2Z(g) 进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
右图曲线a表示放热反应 2X(g)+Y(g)?2Z(g) 进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 加催化剂 | B. | 加大X的投入量 | C. | 升高温度 | D. | 增大体积 |
13.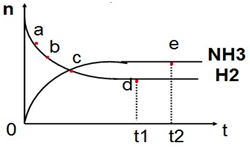 对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),△H<0在400℃2MPa下,n(NH3)和n(H2)随时间变化的关系如图所示,下列叙述正确的是( )
对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),△H<0在400℃2MPa下,n(NH3)和n(H2)随时间变化的关系如图所示,下列叙述正确的是( )
 对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),△H<0在400℃2MPa下,n(NH3)和n(H2)随时间变化的关系如图所示,下列叙述正确的是( )
对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),△H<0在400℃2MPa下,n(NH3)和n(H2)随时间变化的关系如图所示,下列叙述正确的是( )| A. | 点a的正反应速率比点b的小 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d和点e处n(N2)不一样 | |
| D. | 其他条件不变,500℃下反应至t1时刻,n(H2)比图中点d的值大 |
10.某固体物质只含有钠和氧两种元素,将它放在足量的水中产生两种气体,这两种气体又可以在一定条件下反应生成水.则原固体物质的组成是( )
| A. | Na2O2与Na2O | B. | Na和NaOH量 | C. | Na和Na2O | D. | Na2O2和Na |
17.现有三组分散系:①汽油和氯化钠溶液 ②碘的四氯化碳溶液 ③碘水,分离以上各混合液的正确方法依次是( )
| A. | 分液、萃取、蒸馏 | B. | 分液、蒸馏、萃取 | C. | 萃取、蒸馏、分液 | D. | 蒸馏、萃取、分液 |
7.漂白粉的有效成分是( )
| A. | CaCl2 和Ca(ClO)2 | B. | Ca(ClO)2 | C. | CaCl2 | D. | CaCO3 |
14.1mol•L-1的NaCl溶液表示( )
| A. | 溶液中含有1 mol NaCl | B. | 1 mol NaCl溶于1 L水中 | ||
| C. | 58.5 g NaCl溶于941.5 g水中 | D. | 1 L溶液中含有NaCl 58.5 g |
11.用0.1mol/L的FeSO4溶液100mL,恰好将2×10-3mol的XO4-还原,则元素X在还原产物中的化合价是( )
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
18.能正确表示下列反应的离子方程式是( )
| A. | FeO与稀硝酸反应:FeO+2H+═Fe2++H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 溴化亚铁溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2 Br2+6Cl- | |
| D. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ |