题目内容
【题目】已知A、B、C为同一短周期的三种元素,它们的原子序数依次增大且和为41;A是该周期中(除稀有气体元素外)原子半径最大的元素,B元素的原子核外M层上的电子数比K层上的电子数多1。
回答下列问题:
(1)A原子的结构示意图为_________;
(2)C元素位于周期表的第_____周期、第____族;
(3)A和C形成的化合物的电子式为_________;
(4)写出B的最高价氧化物与A的最高价氧化物对应水化物的溶液之间反应的离子方程式_______________________________________。
【答案】 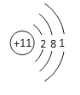 三 VIIA
三 VIIA ![]() Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O
【解析】A、B、C为同一短周期的三种元素,B元素的原子核外M层上的电子数比K层上的电子数多1,故B元素有3个电子层,最外层电子数为,故B为Al元素;A是该周期中(除稀有气体元素外)原子半径最大的元素,故A为Na元素;A、B、C的原子序数和为41,故C的原子序数为41-11-13=17,故C为Cl元素;
(1)由上述分析可知,A为Na元素,原子核外有11个电子,有3个电子层,最外层电子数为1,原子的结构示意图为 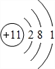 ;
;
(2)Cl元素的核电荷数为17,在周期表中位置为第三周期第VIIA族;
(3)A和C形成的化合物是NaCl,属于离子化合物,由钠离子与氯离子构成,电子式为![]() ;
;
(4)B的最高价氧化物为Al2O3,A的最高价氧化物对应水化物为NaOH,氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O。

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目