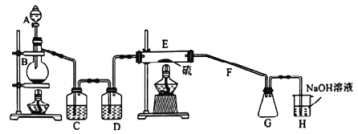
题目内容
【题目】在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况图所示,回答下列问题。
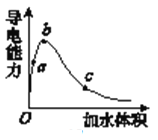
(1)“O”点时液体不能导电,说明醋酸中________离子键(填“含有”或“不含”)。
(2)a、b、c三点醋酸电离程度由大到小的顺序为________;a、b、c三点对应的溶液中c(H+)最大的是________。
(3)要使c点溶液中c(CH3COO-)增大而c(H+)减小,可采取的两种措施是_______________
(4)若实验测得c点处溶液中c(CH3COOH)=0.1 mol·L-1,c(CH3COO-)=0.001 mol·L-1,则该条件下CH3COOH的电离常数Ka=________。电离度是______________。
(5)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是(____)
A.c(H+) B.H+个数
C.CH3COOH分子数 D.![]()
【答案】 不含 c>b>a b 加入锌、NaOH或CH3COONa(其他合理答案也可) 1×10-5 10% BD
【解析】试题(1)“O”点时液体不能导电,说明醋酸熔融状态下不能电离;(2)弱电解质溶液浓度越小,电离程度越大;离子浓度越大,溶液导电能力越大;(3) c点溶液中加入醋酸钠,醋酸的电离平衡逆向移动,c(CH3COO-)增大而c(H+)减小;c点溶液中加入氢氧化钠,氢离子浓度减小,醋酸的电离平衡正向移动,c(CH3COO-)增大;(4)根据![]() 计算;电离度=已经电离的醋酸÷电离前醋酸的浓度×100%;(5) 在稀释过程中,醋酸电离程度增大,c(CH3COOH)减小,由于溶液体积变大,所以c(H+)、c(CH3COO-)均减小;
计算;电离度=已经电离的醋酸÷电离前醋酸的浓度×100%;(5) 在稀释过程中,醋酸电离程度增大,c(CH3COOH)减小,由于溶液体积变大,所以c(H+)、c(CH3COO-)均减小;
解析:(1)“O”点时液体不能导电,说明醋酸熔融状态下不能电离,属于共价化合物,不含离子键;(2)弱电解质溶液浓度越小,电离程度越大,a、b、c三点醋酸的浓度依次减小,所以a、b、c三点醋酸的电离程度依次增大;根据图示a、b、c三点的导电能力b>a>c,所以a、b、c三点对应的溶液中c(H+)最大的是b;(3) c点溶液中加入醋酸钠,醋酸的电离平衡逆向移动,c(CH3COO-)增大而c(H+)减小;c点溶液中加入氢氧化钠,氢离子浓度减小,醋酸的电离平衡正向移动,c(CH3COO-)增大;所以要使c点溶液中c(CH3COO-)增大而c(H+)减小,可采取的两种措施是NaOH或CH3COONa;(4)c(CH3COO-)=c(H+)= 0.001 mol·L-1,c(CH3COOH)=0.1 mol·L-1,![]() =
=![]() ;电离度=已经电离的醋酸÷电离前醋酸的浓度×100%=0.001 mol·L-1÷(0.001+0.1) ×100%=10%;(5) 在稀释过程中,醋酸电离程度增大,所以H+个数增大, CH3COOH分子数减小;由于溶液体积变大,所以c(H+)、c(CH3COO-)均减小;
;电离度=已经电离的醋酸÷电离前醋酸的浓度×100%=0.001 mol·L-1÷(0.001+0.1) ×100%=10%;(5) 在稀释过程中,醋酸电离程度增大,所以H+个数增大, CH3COOH分子数减小;由于溶液体积变大,所以c(H+)、c(CH3COO-)均减小;![]() ,c(CH3COO-)减小,所以
,c(CH3COO-)减小,所以![]() 增大,故正确的是BD。
增大,故正确的是BD。

【题目】(题文)从樟科植物枝叶提取的精油中含有下列甲、乙、丙三种成分:

丙
分子式 | C16H14O2 |
部分性质 | 能使Br2/CCl4褪色 |
能在稀H2SO4中水解 |
(1)甲中含氧官能团的名称为________。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):

其中反应Ⅰ的反应类型为________,反应Ⅱ的化学方程式为_______________(注明反应条件)。
(3)已知:RCH===CHR′![]() RCHO+R′CHO;2HCHO
RCHO+R′CHO;2HCHO![]() HCOOH+CH3OH
HCOOH+CH3OH
由乙制丙的一种合成路线图如下(A~F均为有机物,图中Mr表示相对分子质量):

①下列物质不能与C反应的是________(选填序号)。
a.金属钠 b.HBr c.Na2CO3溶液 d.乙酸
②写出F的结构简式__________________________________。
③丙有多种同分异构体,写出能同时满足下列条件的同分异构体________。
a.苯环上连接三种不同官能团
b.能发生银镜反应
c.能与Br2/CCl4发生加成反应
d.遇FeCl3溶液显示特征颜色
④综上分析,丙的结构简式为____________________________。