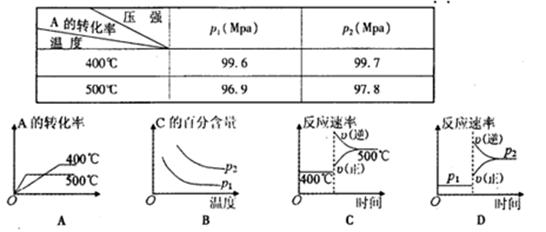
题目内容
可逆反应2SO2(g)+O2(g) 2SO3(g),根据下表中的数据判断下列图像错误的是
2SO3(g),根据下表中的数据判断下列图像错误的是
 | pl(Mpa) | P2(Mpa) |
| 400℃ | 99.6 | 99.7 |
| 500℃ | 96.9 | 97.8 |

C
解析试题分析:从表中数据可知,升高温度,转化率降低,故正反应放热,ΔH<0;增大压强,平衡正向移动,转化率增大,故有P1<P2;A、温度越高,反应速率越快,转化率越大,正确;B、温度升高,平衡逆向移动,SO3百分含量降低,增大压强,平衡正向移动,SO3的百分含量升高,正确;C、增大压强,正逆反应速率均增大,平衡向正向移动,故υ(正)> υ(逆),错误;D、升高温度,正逆反应速率均增大,平衡逆向移动,正确。
考点:考查影响化学反应速率和化学平衡的因素以及化学平衡图像问题。

一定量的锌粉和6mol·L-1的过量盐酸反应,当向其中加入少量的下列物质时,一定能够加快反应速率,又不影响产生H2总量的是( )
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥无水乙酸
| A.①③④ | B.②④⑥ | C.②⑤⑥ | D.①③⑤ |
在一密闭恒容容器中发生如下反应:aX(g)+bY(g) cZ(g) ΔH>0,达平衡后,当其他条件不变时,下列说法正确的是
cZ(g) ΔH>0,达平衡后,当其他条件不变时,下列说法正确的是
| A.升高温度,正反应速率增大,逆反应速率减小, 平衡常数增大 |
| B.若通入稀有气体平衡不移动,则a+b=c |
| C.若加入催化剂,反应速率改变,但平衡不移动 |
| D.若增加X的量,平衡正向移动,X的转化率增大 |
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0
CO2(g)+H2(g) ΔH<0
反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
| A.增加压强 | B.降低温度 | C.增大CO的浓度 | D.更换催化剂 |
7000C时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)  CO2(g)+H2(g);反应过程中测定的部分数据见下表(表中t2>t1)
CO2(g)+H2(g);反应过程中测定的部分数据见下表(表中t2>t1)
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | | 0.20 |
下列说法中正确的是
A.反应在t1 min内的平均速率为υ(CO2)=
 mol·L-1·min-1
mol·L-1·min-1B.到t1 min时,反应未达平衡状态
C. 保持7000C不变,向平衡体系中再通入0.60molCO和0.30 molH2O,达到新平衡时与原平衡相比,CO转化率增大,H2的体积分数增大
D.温度升至8000C时,上述反应的平衡常数为0.64,则正反应为放热反应
已知反应mX(g)+nY(g) qZ(g)+pW(s)的ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法一定正确的是
qZ(g)+pW(s)的ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法一定正确的是
| A.通入氦气使密闭容器中压强增大,平衡向正反应方向移动 |
| B.增加X的物质的量,混合气体的密度减小 |
| C.降低温度,混合气体的平均相对分子质量增大 |
| D.X的正反应速率是Y的逆反应速率的m/n倍 |
某研究小组研究了其他条件不变时,改变条件对以下可逆反应的影响:
2SO2(g)+O2(g) 2SO3(g) +Q
2SO3(g) +Q
下列说法正确的是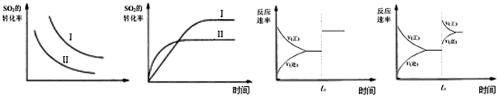
图一 图二 图三 图四
| A.图一研究的是温度、压强对平衡的影响,横坐标表示压强 |
| B.图二研究的是温度对平衡的影响,Ⅱ采用的温度更高 |
| C.图三中t0时使用了催化剂,使平衡向正反应方向进行 |
| D.图四中t0时增大压强,使平衡向正反应方向进行 |
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究。T10C 时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法错误的是
CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法错误的是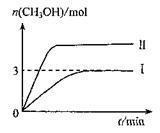
| A.曲线II对应的条件改变是增大压强 |
| B.T2°C时,上述反应平衡常数为0.42,则T2> T1 |
| C.在T10C,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和5 mol H2O(g),则达平衡前v(正)>v(逆) |
D.在T10C,若起始时向容器由通入4,5 molCO2、6mol H2 ,平衡时容器内压强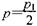 |
 2C(g),根据下表中的数据判断下列图像错误的是
2C(g),根据下表中的数据判断下列图像错误的是