题目内容
【题目】下列各组离子能大量共存的是
A. Na+、Mg2+、CO32-、I-
B. H+ NO3-、Fe2+、Br-
C. NH4+、K+、SO42-、Cl-
D. Na+、S2-、Cu2+、SO32-
【答案】C
【解析】
试题分析:A.在溶液中Mg2+、CO32-不能大量共存,A错误;B.在溶液中H+ NO3-、Fe2+以及Br-之间发生氧化还原反应,不能大量共存,B错误;C. NH4+、K+、SO42-、Cl-离子间不反应,可以大量共存,C正确;D.S2-、Cu2+不能大量共存,D错误,答案选C。

【题目】(1)请用下列10种物质的序号填空:①O2②H2③NH4NO3④K2O2⑤Ba(OH)2⑥CH4⑦CO2⑧NaF ⑨NH3⑩I2
既有离子键又有非极性键的是________;既有离子键又有极性键的是________。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为:______________;若XY2为共价化合物时,其结构式为:__________________。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃(2.02×103Pa),但在180℃就开始升华,据此判断,氯化铝是________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是____________________。
(4)现有a~g 7种短周期元素,它们在周期表中的位置如下,请据此回答下列问题:
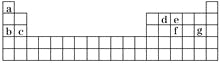
①元素的原子间反应最容易形成离子键的是________(填序号,下同),容易形成共价键的是______;
A.c和f | B.b和g | C.d和g | D.b和e |
②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式______。
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | C | N | O | F | ||||
3 | Na | Mg | Al | S | Cl | Ar |
(1)非金属性最强的元素是 ;
(2)化学性质最不活泼的单质是 ;
(3)C和O中,原子半径较大的是 ;
(4)某离子的结构示意图为![]() ,该离子的符号为__________;
,该离子的符号为__________;
(5)硫有两种重要氧化物,分别为SO2和 (填化学式);
(6)H2S和HCl中,热稳定性较强的是 ;
(7)NaOH、Mg(OH)2、Al(OH)3中,碱性最强的是 ;属于两性氢氧化物的是 ;
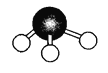
(8)氮的一种气态氢化物的分子球棍模型如图所示,写出它的化学式 ,其水溶液显 (填“酸性”或“碱性”),此氢化物中N元素和H元素的质量比m(N)∶m(H)= ;
(相对原子质量:N一14 H—1)