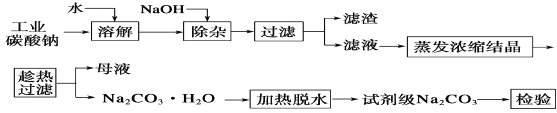
题目内容
【题目】工业上常用SiO2与C在高温下发生反应制造粗硅,粗硅中含有SiC,其中Si和SiC的物质的量之比为1∶1。下列说法正确的是( )
A.硅元素在地壳中含量居第二位,主要以单质硅和硅酸盐的形式存在
B.纯净的SiO2只能用于制造光导纤维
C.SiC因有很高的化学稳定性和热稳定性,故可用作高温结构陶瓷材料。
D.制造粗硅时的上述反应方程式为:2SiO2+5C![]() Si+SiC+4CO↑
Si+SiC+4CO↑
【答案】CD
【解析】
试题分析:A.硅元素在地壳中含量居第二位,硅属于亲氧元素,主要以硅酸盐和二氧化硅的形式存在,故A错误;B.纯净的SiO2除了制造光导纤维,还可用于制造光学玻璃等,故B错误;C.SiC具有很高的化学稳定性和热稳定性,可用作高温结构陶瓷材料,故C正确;D.粗硅中含有SiC,其中Si和SiC的物质的量之比为1:1,根据原子守恒,可写出化学方程式:2SiO2+5C![]() Si+SiC+4CO↑,故D正确;故选CD。
Si+SiC+4CO↑,故D正确;故选CD。

 名校课堂系列答案
名校课堂系列答案【题目】实验需要0.80 mol·L-1NaOH溶液475 mL和0.40 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
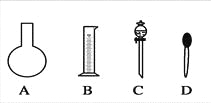
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)下列操作中,不能用容量瓶实现的有______________(填序号)。
A.配制一定体积准确浓度的标准溶液 |
B.量取一定体积的液体 |
C.测量容量瓶规格以下的任意体积的液体 |
D.准确稀释某一浓度的溶液 |
E.贮存溶液
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为___________g。在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度_________(填”大于”、“等于”或“小于”,下同)0.8 mol·L-1。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度__________0.8 mol·L-1。
(4)根据计算得知,所需质量分数为98 %、密度为1.84 mol·L-1的浓硫酸的体积为__________mL(计算结果保留一位小数)。如果实验室有10 mL、15 mL、20 mL、50 mL量筒,选用___________mL量筒最好。