题目内容
【题目】某固定体积的密闭容器中,加入—定量的A达化学平衡: aA(g)![]() B(g)+c(g),在温度不变的条件下,再充入一定量的A物质,重新达到平衡时,下列判断中正确的是
B(g)+c(g),在温度不变的条件下,再充入一定量的A物质,重新达到平衡时,下列判断中正确的是
A. 若a=b+c时,B的物质的量分数变大 B. 若a=b+c时,B的物质的量分数不变
C. 若a>b+c时,A的转化率不变 D. 若a<b+c时,A的转化率变大
【答案】B
【解析】试题分析:A.若a=b+c时,反应两边气体体积不变,压强不影响平衡,B的含量不变,故A错误;B.若a=b+c时,反应两边气体体积不变,加入A达到新的平衡后,各组分含量不变,故B正确;C.若a>b+c,加入A后,达到新的平衡,与原平衡相比,由于压强增大了,平衡向着正向移动,A的转化率增大了,故C错误;D.a<b+c时,加入A后,达到新的平衡,与原平衡相比,由于压强增大了,平衡向着逆向移动,A的转化率减小,故D错误;故选B。

【题目】锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β-锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如图所示:
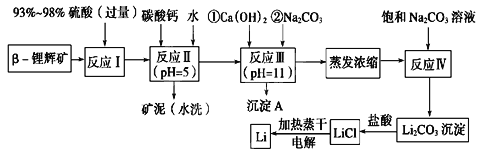
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH如下表:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
②Li2CO3在不同温度下的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
请回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:________________________。
(2)反应Ⅱ加入碳酸钙的作用是___________________。
(3)流程中两次使用碳酸钠溶液,请说明前后两次使用中浓度不同的原因:______________。
(4)洗涤所得Li2CO3沉淀要使用________(填“热水”或“冷水”),你选择的理由是________________。
(5)将盐酸与Li2CO3完全反应后的溶液,加热蒸干得到固体,再将其熔融电解生产锂。电解时产生的氯气中会混有少量氧气,原因是:__________________________。
(6)下列关于金属锂及碱金属的说法正确的是___________(填序号)。
A.锂是碱金属,其熔点高于钠 B.根据对角线原则,氢氧化锂是强碱
C.金属锂的氧化物形式十分复杂 D.碱金属中密度最小的是锂,其次是钠