题目内容
19.现有34g某气体,它的摩尔质量为17g•mol-1.则:①该气体的物质的量为2 mol.
②该气体所含分子数为1.204×1024或2NA.
③该气体在标准状况下的体积为44.8 L.
④该气体完全溶于水,配成500mL溶液,所得溶液溶质的物质的量浓度为:4mol•L-1.
分析 根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$=cV计算.
解答 解:①n=$\frac{34g}{17g/mol}$=2mol,故答案为:2;
②N=2mol×6.02×1023/mol=1.204×1024或2NA,故答案为:1.204×1024或2NA;
③V=2mol×22.4L/mol=44.8L,故答案为:44.8;
④c=$\frac{2mol}{0.5L}$=4mol/L,故答案为:4 mol•L-1.
点评 本题综合考查物质的量的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握相关计算公式的运用,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.经氯气消毒的自来水,用以配制以下溶液,不会使溶液变质的是( )
| A. | AgNO3溶液 | B. | FeCl2溶液 | C. | Na2CO3溶液 | D. | NaCl溶液 |
10.在下列操作中,所使用的仪器能够达到目的是( )
| A. | 用5mL量筒准确量取4.55mL水 | |
| B. | 用分析天平准确地称取6.82g食盐 | |
| C. | 过滤时用玻璃棒搅拌漏斗内的液体,以加速过滤 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
7.下列离子方程式正确的是( )
| A. | 碳酸氢钠溶液与少量石灰水反应:HCO3-+OH-+Ca2+═H2O+CaCO3↓ | |
| B. | 氯化铵与氢氧化钠溶液混合:NH4++OH-═H2O+NH3↑ | |
| C. | 向漂白粉溶于水形成的溶液中通入少量的SO2:Ca2++3ClO-+SO2+H2O═CaSO4↓+Cl-+2HClO | |
| D. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ |
14.下列说法正确的是( )
| A. | 氯气有漂白性,能使湿润的有色布条褪色 | |
| B. | 漂白粉的有效成分是CaCl2,应密封保存 | |
| C. | 欲除去氯气中混有的少量氯化氢气体,可将混合气体通过盛有NaOH溶液的洗气瓶 | |
| D. | 进行铜丝在氯气中燃烧的实验时,集气瓶内应铺一层细沙 |
4.同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和O2,②NO2和O2,③NH3和N2.现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是( )
| A. | V1>V2>V3 | B. | V1>V3>V2 | C. | V3>V2>V1 | D. | V3>V1>V2 |
11.下列物质的转化在给定条件下能实现的是( )
| A. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | 饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 | |
| D. | MgCl2(aq)$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{煅烧}{→}$MgO |
8.下列发展中的化学电源中不属于充电电池的是( )
| A. | 铅蓄电池 | B. | 锂离子电池 | C. | 锌锰电池 | D. | 镍镉电池 |
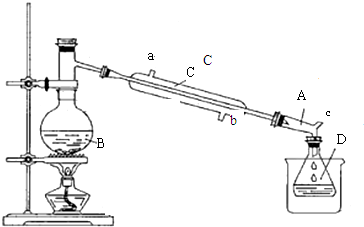
3.溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的反应和实验装置如图:
反应:CH3CH2OH+HBr $\stackrel{△}{→}$ CH3CH2Br+H2O
装置:
实验中可能用到的数据如下表:
①合成反应:在仪器B中加入适量NaBr、浓硫酸和50mL乙醇,安装好仪器,缓缓加热,收集馏出物.
②分离提纯:将馏出物加水后振荡,再加入适量酸除去乙醚,分液,最后得到52mL溴乙烷.
回答下列问题:
(1)加入试剂前一般在B中加少量碎瓷片,目的是防止瀑沸.
(2)仪器B的名称是蒸馏烧瓶.
(3)仪器C为直形冷凝管,冷水进口是b(填“a”或“b”).
(4)仪器D置于盛有冰水混合物的烧杯中,目的是冷却溴乙烷.
(5)溴乙烷粗产品可能混有多种杂质,在②分离提纯阶段,加水的目的是为了除除去溶解在溴乙烷中乙醇.
(6)该实验所得溴乙烷的产率为79%.(保留两位有效数值)
反应:CH3CH2OH+HBr $\stackrel{△}{→}$ CH3CH2Br+H2O
装置:

实验中可能用到的数据如下表:
| 物 质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3) | 水溶性 |
| CH3CH2OH | 46 | 78.4 | 0.79 | 互溶 |
| CH3CH2Br | 109 | 38.4 | 1.42 | 难溶 |
| CH3CH2OCH2CH3 | 74 | 34.5 | 0.71 | 微溶 |
| CH2=CH2 | 28 | -103.7 | 0.38 | 不溶 |
| 浓硫酸(H2SO4) | 98 | 338.0 | 1.38 | 易溶 |
②分离提纯:将馏出物加水后振荡,再加入适量酸除去乙醚,分液,最后得到52mL溴乙烷.
回答下列问题:
(1)加入试剂前一般在B中加少量碎瓷片,目的是防止瀑沸.
(2)仪器B的名称是蒸馏烧瓶.
(3)仪器C为直形冷凝管,冷水进口是b(填“a”或“b”).
(4)仪器D置于盛有冰水混合物的烧杯中,目的是冷却溴乙烷.
(5)溴乙烷粗产品可能混有多种杂质,在②分离提纯阶段,加水的目的是为了除除去溶解在溴乙烷中乙醇.
(6)该实验所得溴乙烷的产率为79%.(保留两位有效数值)