题目内容
10.已知碳酸氢钠溶液与氢氧化钠溶液混合后,能发生下列离子反应:HCO3-+OH-═CO32-+H2O,现往溶液中滴入少量澄清石灰水,有关溶液中发生反应的离子方程式正确的是( )| A. | HCO3-+OH-═CO32-+H2O | |
| B. | Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | CO32-+Ca2+═CaCO3↓ | |
| D. | Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
分析 若原溶液中HCO3-过量,往溶液中滴入少量澄清石灰水后发生反应为:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O;若原溶液中OH-过量,往溶液中滴入少量澄清石灰水后发生反应为:CO32-+Ca2+═CaCO3↓,据此进行解答.
解答 解:A.溶液中含有Ca2+,则反应中一定有CaCO3生成,故A错误;
B.澄清石灰水少量,离子方程式按照氢氧化钙的组成书写,正确的离子方程式为:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O,故B错误;
C.当氢氧化钠过量时,反应的离子方程式为:CO32-+Ca2+═CaCO3↓,故C正确;
D.碳酸氢根离子过量时,澄清石灰水少量,离子方程式按照氢氧化钙的组成书写,反应的离子方程式为:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O,故D正确;
故选CD.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,明确发生反应的实质为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目
1.下列各组离子在相应的条件下可能大量共存的是( )
| A. | 能使甲基橙变红的溶液中:NO3-、Fe2+、Cl-、Na+ | |
| B. | 在c(OH-)/c(H+)=1×1012的溶液中:SO42-、CO32-、Na+、K+ | |
| C. | 由水电离产生的c(OH-)=1×10-10 mol/L的溶液中:NO3-、Ba2+、SO42-、Fe2+ | |
| D. | 无色透明溶液中:Fe3+、Na+、Cl-、K+ |
18.用98%的浓硫酸(密度为1.84g•cm-3)配制 250mL浓度为0.5mol•L-1的H2SO4溶液,选用的仪器正确的是( )
| 选项 | A | B | C | D |
| 仪器及规格 |  100mL量筒 100mL量筒 |  250mL容量瓶 250mL容量瓶 |  托盘天平 托盘天平 |  锥形瓶 锥形瓶 |
| A. | A | B. | B | C. | C | D. | D |
15.元素的性质呈现周期性变化的根本原因是( )
| A. | 原子半径呈周期性变化 | |
| B. | 元素的化合价呈周期性变化 | |
| C. | 第一电离能呈周期性变化 | |
| D. | 元素原子的核外电子排布呈周期性变化 |
2.检验氨气可选用( )
| A. | 湿润的蓝色石蕊试纸 | B. | 干燥的红色石蕊试纸 | ||
| C. | 干燥的蓝色石蕊试纸 | D. | 湿润的红色石蕊试纸 |
5. 25℃时,向0.10mol•L-1 H2Y溶液中逐渐加入NaOH固体(忽略加入时引起的溶液体积变化),所得溶液中含Y元素的三种微粒的分布系数(浓度分数)δ随溶液pH变化的关系如图”所示,下列说法正确的是( )
25℃时,向0.10mol•L-1 H2Y溶液中逐渐加入NaOH固体(忽略加入时引起的溶液体积变化),所得溶液中含Y元素的三种微粒的分布系数(浓度分数)δ随溶液pH变化的关系如图”所示,下列说法正确的是( )
 25℃时,向0.10mol•L-1 H2Y溶液中逐渐加入NaOH固体(忽略加入时引起的溶液体积变化),所得溶液中含Y元素的三种微粒的分布系数(浓度分数)δ随溶液pH变化的关系如图”所示,下列说法正确的是( )
25℃时,向0.10mol•L-1 H2Y溶液中逐渐加入NaOH固体(忽略加入时引起的溶液体积变化),所得溶液中含Y元素的三种微粒的分布系数(浓度分数)δ随溶液pH变化的关系如图”所示,下列说法正确的是( )| A. | 曲线上任意一点均存在:c(H+)+c(Na+)═c(OH-)+c(Y2-)+c(HY-) | |
| B. | c(Na+)=0.10 mol•L-1时,溶液中的c(H+)+c(H2Y)═c(OH-)+c(Y2-) | |
| C. | 由图可知,H2Y为二元弱酸,如果将物质的量浓度均为0.20mol•L-1的NaHY和Na2Y溶液等体积混合,所得溶液的pH=4.2 | |
| D. | 已知25℃时,HCOOH的Ka=1×10-4.若把少量H2Y加入到HCOONa溶液中,发生的离子反应可表示为:H2Y+2HCOO-═2HCOOH+Y2- |
 . G的一种合成路线如下:
. G的一种合成路线如下:


 ;X生成Y的反应类型是消去反应.
;X生成Y的反应类型是消去反应.
 .
.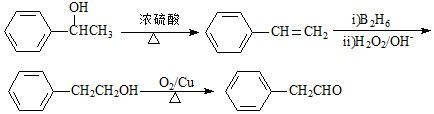 .
.