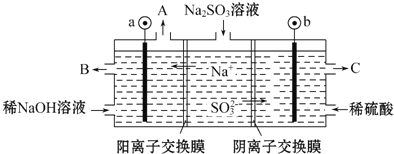
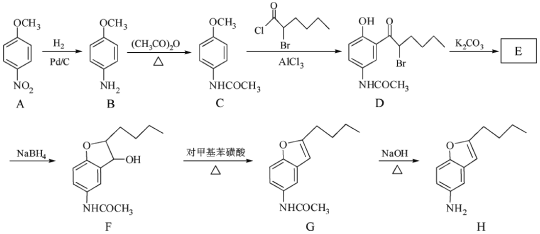
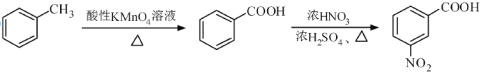
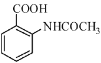
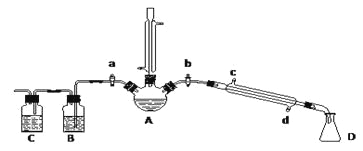
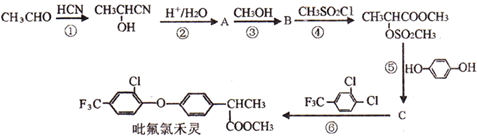
题目内容
【题目】12.8 g铜和浓HNO3反应,随反应进行,产生气体的颜色逐渐变浅,铜完全反应时,收集到标准状况下的气体6.72 L,将气体与一定体积的O2同时通入水中可被完全吸收。
(1)通过计算确定收集到的气体成分及物质的量。
(2)O2在标准状况下的体积。
【答案】(1)NO2 0.25 mol,NO 0.05mol;(2)2.24 L。
【解析】
试题分析:(1)设气体中NO2、NO的物质的量分别为x、y,根据题意气体体积:![]() ,根据得失电子数目守恒
,根据得失电子数目守恒 ![]() ,两式联立解得解之得x=0.25 mo,y=0.05 mol,则:NO2 0.25 mol,NO 0.05mol;(2)根据氧气最终得到电子来自于铜,则有:
,两式联立解得解之得x=0.25 mo,y=0.05 mol,则:NO2 0.25 mol,NO 0.05mol;(2)根据氧气最终得到电子来自于铜,则有:![]() ÷4×22.4 L/mol=2.24 L。
÷4×22.4 L/mol=2.24 L。

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目