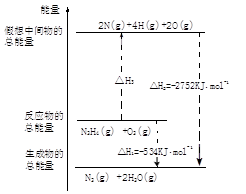题目内容
氮化硅是一种重要的结构陶瓷材料,它是一种超硬物质,本身具有润滑性,并且耐磨损。一定条件下,氮气、氢气与四氯化硅反应可以制得氮化硅,化学反应方程式为:3SiCl4+6H2+2N2 → Si3N4+12HCl
氮的氢化物肼(N2H4)是航天火箭发射常用的燃料,二氧化氮作氧化剂。
回答以下问题:
(1)氮原子的最外层电子排布式是_________________;氮元素有多种化合价,写出含2种价态氮的化合物的化学式_________________(举一例)。
(2)硅原子核外电子排布在______________种不同能量的电子亚层上,氮化硅属______________晶体。
(3)上述反应中,属于同一周期的元素符号有_________,用___________________________事实可以比较它们的非金属性强弱。
(4)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2取代形成的另一种氮的氢化物。NH3分子的空间构型是______________;与N2H4分子具有相同电子数的分子有多种,其中具有可燃性的物质是_________(举一例)。
(5)肼作火箭发射燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l) → 3N2(g)+4H2O(g)+1038.7kJ若该反应中有4mol N-H键断裂,则形成的气体有_____mol,其中转移电子数目_____。
(6)肼能与硫酸反应生成N2H6SO4。该物质晶体类型与硫酸铵相同,则其溶液PH_______7(填>、<或=),原因是____________________(用离子方程式表示)
(1)2s22p3 ;NH4NO3 或 NH4NO2(合理给分) (2分)
(2)5; 原子 (2分)
(3)Si、 Cl ; 氢化物稳定性或最高价氧化物对应水化物酸性 (2分)
(4)三角锥形 ; C2H6 (合理给分)(2分)
(5)3.5 ; 4NA(NA代表阿伏伽德罗常数 )或2.408×1024 (2分)
(6)< ;N2H62+ +2H2O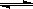 N2H4·2H2O+2H+(合理给分)(2分)
N2H4·2H2O+2H+(合理给分)(2分)
解析试题分析:(1)氮原子是7号元素,最外层电子排布式为2s22p3;2种价态氮的化合物的化学式NH4NO3 或 NH4NO2。
(2)硅原子是14号元素,核外电子排布式为1S22s22p6 3S23P2能层和能级其中任一项不同,即轨道能量不同,故核外电子排布在5种不同能量的电子亚层上,氮化硅是一种超硬物质据此性质可知氮化硅属于原子晶体。
(3)上述反应中,属于同一周期的元素符号有Si、 Cl ; ,用氢化物稳定性或最高价氧化物对应水化物酸性事实可以比较它们的非金属性强弱。
(4)NH3分子中氮原子发生了SP3杂化,但配位原子只有3个,故其空间构型是三角锥形;与N2H4分子具有相同电子数的分子有多种,其中具有可燃性的物质是 C2H6。
(5)N2O4(l)+2N2H4(l) → 3N2(g)+4H2O(g)+1038.7kJ反应中有4mol N-H键断裂,即有1molN2H4发生了反应,则形成的气体有3.5mol,其中转移电子数目 4NA。
(6)硫酸铵是强酸弱碱盐,可知该物质也是,则其溶液PH小于7,水解方程式可写为N2H62+ +2H2O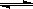 N2H4·2H2O+2H+。
N2H4·2H2O+2H+。
考点:本题主要考查原子轨道的能量判断,分子的空间构型,盐类的水解等知识。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案浩瀚的海洋是一个巨大的宝库,蕴含有80多种元素,可供提取利用的有50多种。
(1)其中“氯碱工业”就是以食盐水为原料制取Cl2等物质,有关的化学方程式为: 。
(2)实验室用二氧化锰制取氯气的化学方程式为: ;根据上述实验原理,从下列装置中选择合适的发生装置用于实验室制取少量氯气 (填写装置的序号)。
(3)实验室中模拟Br—→Br2的转化,可以通过在KBr溶液中滴加少量新制氯水的实验进行实现。写出Br—→Br2的转化离子方程式为: ;氯水不稳定,要现用现配,下列吸收氯气制备氯水的装置最合理的是 (选填下列选项的编号字母)。
(4)实验室制备氯气的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学进行了以下实验:取100 mL残余液放入烧杯中,将烧杯(含玻璃棒)放在电子天平上(如右图),再把已称好50.0 g CaCO3粉末慢慢加入到残余液中,边加边搅拌使其充分反应。观察读数变化如下表所示:
| CaCO3用量 | 未加CaCO3时 | 加约四分之一时 | 加一半时 | 全部加完时 |
| 读数/g | 318.3 | 325.3 | 334.5 | 359.5 |
①实验中产生的CO2气体质量为 ;
②残余液中盐酸的物质的量浓度为 (结果精确到小数点后一位) 。

 Ni(OH)2+M
Ni(OH)2+M

 ,可能含有CO
,可能含有CO
 的离子方程式为_____________________________________;
的离子方程式为_____________________________________;