题目内容
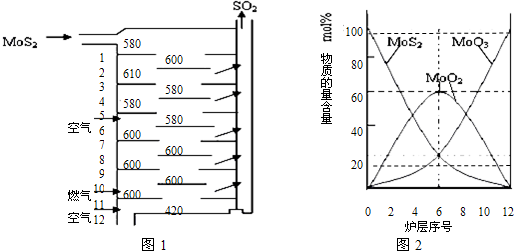
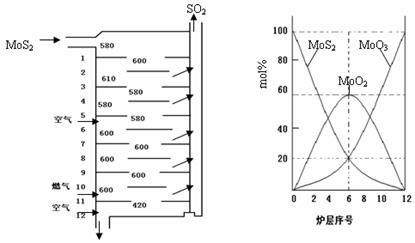
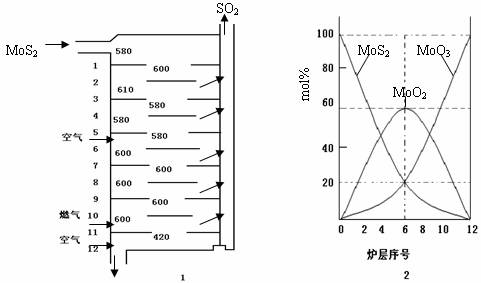
辉钼矿(MoS2)是钼最重要的矿物.图l是辉钼矿多层焙烧炉的示意图,其中1,2,3,…是炉层编号.580,600,610,…是各炉层的温度(℃).图2给出了各炉层的固体物料的摩尔百分组成.已知:MoS2焙烧生成1molMoO3的反应热为△H1=-1011KJ/mol,MoO2氧化生成lmolMoO3的反应热为△H2=-154KJ/mol.试回答:

(l)辉铝矿焙烧生成MoO3的反应中被氧化的元素是: (填元素符号);指出辉钼矿焙烧生成的尾气对环境的一种危害:
(2)第6炉层存在的固体物质分别是: 它们的物质的量之比是:
(3)辉钼矿焙烧生成MoO3的热化学反应方程式是:
(4)图2表明,中间炉层(4--6)可能存在一种“固体+固体、固体+…”的反应,请写出该反应的化学方程式: .
(5)通过(3)和(4)你能解释为什么中间炉层(4一6)的炉温比上下炉层的炉温低吗? .

(l)辉铝矿焙烧生成MoO3的反应中被氧化的元素是:
(2)第6炉层存在的固体物质分别是:
(3)辉钼矿焙烧生成MoO3的热化学反应方程式是:
(4)图2表明,中间炉层(4--6)可能存在一种“固体+固体、固体+…”的反应,请写出该反应的化学方程式:
(5)通过(3)和(4)你能解释为什么中间炉层(4一6)的炉温比上下炉层的炉温低吗?
分析:(1)辉铝矿焙烧生成MoO3的反应过程中是MoS2和氧气反应生成二氧化硫和MoO3,依据元素化合价升降分析反应中被氧化的元素;
(2)依据图象分析存在的固体物质;
(3)MoS2焙烧是和氧气反应生成二氧化硫和1molMoO3的反应热为△H1=-1011KJ/mol,依据热化学方程式书写方法写出;
(4)图中曲线在4--6 变化趋势MoO2是增大,MoS2和MoO3是反应物,结合原子守恒配平书写化学方程式;
(5)依据辉钼矿焙烧生成MoO3的热化学反应方程式和MoO2氧化生成lmolMoO3的反应的热化学方程式,根据盖斯定律计算得到4-6层反应的热化学方程式进行分析判断;
(2)依据图象分析存在的固体物质;
(3)MoS2焙烧是和氧气反应生成二氧化硫和1molMoO3的反应热为△H1=-1011KJ/mol,依据热化学方程式书写方法写出;
(4)图中曲线在4--6 变化趋势MoO2是增大,MoS2和MoO3是反应物,结合原子守恒配平书写化学方程式;
(5)依据辉钼矿焙烧生成MoO3的热化学反应方程式和MoO2氧化生成lmolMoO3的反应的热化学方程式,根据盖斯定律计算得到4-6层反应的热化学方程式进行分析判断;
解答:解:(1)辉铝矿焙烧生成MoO3的过程中是MoS2和氧气反应生成二氧化硫和MoO3,依据元素化合价升降分析反应中被氧化的元素,元素化合价升高的被氧化,反应中被氧化的元素是Mo和S;辉钼矿焙烧生成的尾气二氧化硫是对环境产生危害,二氧化硫是形成酸雨的主要来源;
故答案为:Mo和S,形成酸雨;
(2)分析图象可知第6层存在的固体物质分别为MoS2、MoO3、MoO2,图象分析MoS2、MoO3、物质的量百分比为20%,MoO2 的物质的量百分比为60%,则MoS2、MoO3、MoO2 的物质的量之比=1:1:3;
故答案为:MoS2、MoO3、MoO2,1:1:3;
(3)MoS2焙烧生成1molMoO3的反应热为△H1=-1011KJ/mol,反应的热化学方程式为:MoS2(s)+
O2(g)=MoO3(s)+2SO2(g)△H=-1011KJ/mol;
故答案为:MoS2(s)+
O2(g)=MoO3(s)+2SO2(g)△H=-1011KJ/mol;
(4)图2表明,中间炉层(4--6)可能存在一种“固体+固体,依据图象变化减小的是反应物,增大的是生成物,反应的化学方程式为:MoS2+6MoO3=7MoO2+2SO2;
故答案为:MoS2+6MoO3=7MoO2+2SO2;
(5)由①MoS2(s)+
O2(g)=MoO3(s)+2SO2(g)△H=-1011KJ/mol和②MoO2(s)+
O2(g)=MoO3(s)△H=-154KJ/mol
依据盖斯定律计算得到③MoO2(s)+6MoO3(s)=7MoO2(s)+2SO2(g)△H=△H1-7△H2=67KJ/mol,焓变大于0,所以反应③是吸热反应,因为其发生在中间层,故炉温降低;
故答案为:由①MoS2(s)+
O2(g)=MoO3(s)+2SO2(g)△H=-1011KJ/mol和②MoO2(s)+
O2(g)=MoO3(s)△H=-154KJ/mol
依据盖斯定律计算得到③MoO2(s)+6MoO3(s)=7MoO2(s)+2SO2(g)△H=△H1-7△H2=67KJ/mol,焓变大于0,所以反应③是吸热反应,因为其发生在中间层,故炉温降低.
故答案为:Mo和S,形成酸雨;
(2)分析图象可知第6层存在的固体物质分别为MoS2、MoO3、MoO2,图象分析MoS2、MoO3、物质的量百分比为20%,MoO2 的物质的量百分比为60%,则MoS2、MoO3、MoO2 的物质的量之比=1:1:3;
故答案为:MoS2、MoO3、MoO2,1:1:3;
(3)MoS2焙烧生成1molMoO3的反应热为△H1=-1011KJ/mol,反应的热化学方程式为:MoS2(s)+
| 7 |
| 2 |
故答案为:MoS2(s)+
| 7 |
| 2 |
(4)图2表明,中间炉层(4--6)可能存在一种“固体+固体,依据图象变化减小的是反应物,增大的是生成物,反应的化学方程式为:MoS2+6MoO3=7MoO2+2SO2;
故答案为:MoS2+6MoO3=7MoO2+2SO2;
(5)由①MoS2(s)+
| 7 |
| 2 |
| 1 |
| 2 |
依据盖斯定律计算得到③MoO2(s)+6MoO3(s)=7MoO2(s)+2SO2(g)△H=△H1-7△H2=67KJ/mol,焓变大于0,所以反应③是吸热反应,因为其发生在中间层,故炉温降低;
故答案为:由①MoS2(s)+
| 7 |
| 2 |
| 1 |
| 2 |
依据盖斯定律计算得到③MoO2(s)+6MoO3(s)=7MoO2(s)+2SO2(g)△H=△H1-7△H2=67KJ/mol,焓变大于0,所以反应③是吸热反应,因为其发生在中间层,故炉温降低.
点评:本题考查了图象分析,流程判断,热化学方程式的书写方法,盖斯定律的计算应用,题目难度中等.

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目