题目内容
【题目】马日夫盐[Mn(H2PO4)2·2H2O]是一种白色晶体,易溶于水,常用于机械设备的磷化处理。以软锰矿(主要成分为MnO2,还含有少量的Fe2O3、FeO和A l 2O3)为原料制备马日夫盐的流程如下:
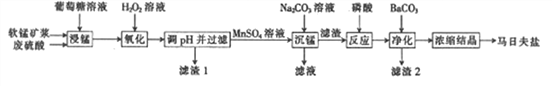
⑴软锰矿要先制成矿浆的目的是______________,葡萄糖(C4H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为___________________。
(2)用H2O2溶液“氧化”时发生反应的离子方程式为_______________________。
(3)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如下表,“调pH并过滤”时,应调整的pH范围为______________,滤渣1的主要成分为____________(填化学式)。
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.8 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
Mn2+ | 7.8 | 9.8 |
(4)加入磷酸后发生反应的化学方程式为_____________________。
(5)某工厂用上述流程制备马日夫盐,已知软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9% ,则1吨该软锰矿可制得马日夫盐________t。
【答案】 增大反应物接触面积,加快反应速率,提高原料利用率 12:1 2Fe2++H2O2+2H+═2Fe3++2H2O 5.0~7.8 Fe(OH)3和Al(OH)3 MnCO3+2H3PO4 =Mn(H2PO4)+CO2↑+H2O 2.59(或2.5935)
【解析】⑴软锰矿要先制成矿浆,可以增大反应物接触面积,加快反应速率,提高原料利用率,葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,反应中MnO2中Mn的化合价由+4变成+2价,是氧化剂,化合价变化2,葡萄糖是还原剂,其中C元素的化合价由0价变成+4价,化合价变化4×6=24,根据化合价升降守恒,氧化剂与还原剂的物质的量之比为12:1,故答案为:增大反应物接触面积,加快反应速率,提高原料利用率;12:1;
(2)用H2O2溶液氧化溶液中的亚铁离子,反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(3)根据几种金属离子的氢氧化物开始沉淀和完全沉淀的pH,“调pH并过滤”时,调整的pH的目的是沉淀铁离子和铝离子,但不能使锰离子沉淀,pH范围为5.0~7.8,滤渣1的主要成分为Fe(OH)3和Al(OH)3,故答案为:5.0~7.8;Fe(OH)3和Al(OH)3;
(4)碳酸钠与硫酸锰反应生成碳酸锰,加入磷酸使碳酸锰生成Mn(H2PO4)2,反应的化学方程式为MnCO3+2H3PO4 =Mn(H2PO4)+CO2↑+H2O,故答案为:MnCO3+2H3PO4 =Mn(H2PO4)+CO2↑+H2O;
(5)根据MnO2 ~ Mn(H2PO4)2·2H2O
87 285
1t×87%×(1-9%) m[Mn(H2PO4)2·2H2O]
则![]() =
=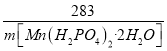 ,解得:m[Mn(H2PO4)2·2H2O]= 2.59t,故答案为:2.59。
,解得:m[Mn(H2PO4)2·2H2O]= 2.59t,故答案为:2.59。

 名题金卷系列答案
名题金卷系列答案【题目】煤气中主要的含硫杂质有H2S以及COS(有机硫),煤气燃烧后含硫杂质会转化成SO2从而引起大气污染。煤气中H2S的脱除程度已成为其洁净度的一个重要指标。回答下列问题:
(1)将H2S通入FeCl3溶液中,该反应的还原产物为___________。
(2)脱除煤气中COS的方法有Br2的KOH溶液氧化法、H2还原法以及水解法等。
①COS的分子结构与CO2相似,COS的电子式为_____________。
②Br2的KOH溶液将COS氧化为硫酸盐和碳酸盐的离子方程式为_____________。
③已知断裂1mol化学键所需的能量如下:
化学键 | H—H | C═O | C═S | H—S | C≡O |
E/kJmol-1 | 436 | 745 | 577 | 339 | 1072 |
H2还原COS发生的反应为H2(g)+COS(g) ═H2S(g)+CO(g),该反应的ΔH=________kJ·mol-1。
④用活性α—Al2O3催化COS水解的反应为COS(g)+ H2 O(g) ![]() CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与
CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与![]() 的关系如图2所示。
的关系如图2所示。


由图1可知,催化剂活性最大时对应的温度约为____________;由图2可知,P点时平衡常数K=_____
(保留2位有效数字)。
(3)常温下可发生反应:ZnS(s)+2H+(aq) ![]() Zn2+(aq)+H2S(aq),达到平衡时,该反应的平衡常数K=_______[已知:Ksp(ZnS)=2.93×10-25;H2S电离常数;Ka1=9.5×10-8,Ka2=1.3×10-14]。
Zn2+(aq)+H2S(aq),达到平衡时,该反应的平衡常数K=_______[已知:Ksp(ZnS)=2.93×10-25;H2S电离常数;Ka1=9.5×10-8,Ka2=1.3×10-14]。