题目内容
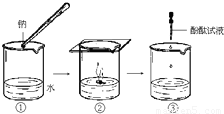
 钠与水反应的过程如图所示.请回答:
钠与水反应的过程如图所示.请回答:
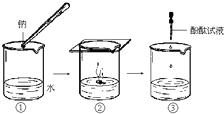
(1)钠与水反应的化学方程式为______.
(2)根据B中的实验现象,说明钠的密度比水的______(填“大”或“小”).
(3)C中滴加酚酞试液后,可观察到溶液变______色.
(4)在实验室中通常将钠保存在______里(填序号).①冷水 ②煤油
(5)现有A、B、C三种白色固体及一种无色气体D.A、B、C均可溶于水,焰色反应均呈黄色,其中C的溶液为碱溶液,且四种物质之间存在如下关系:
①A+D+H2O→B ②B+C→A+H2O
③C+D→A+B ④B A+D+H2O
A+D+H2O
请回答:A是______,D是______(写化学式);反应②的离子方程式是______;少量D通入C的离子方程式是______;反应④的化学方程式是______.
解:(1)钠与水反应的化学方程式为:2Na+2H2O=2NaOH+H2↑,故答案为:2Na+2H2O=2NaOH+H2↑;
(2)钠浮在水面上说明钠的密度比水的小,故答案为:小;
(3)反应后生成氢氧化钠,溶液呈碱性,酚酞变红,故答案为:红;
(4)钠的密度比煤油的小,钠不与煤油反应,少量的钠可以保存在煤油中,故答案为:煤油;
(5)A、B、C均可溶于水,焰色反应均呈黄色说明均含有钠离子,C的溶液为碱溶液,C为NaOH,无色气体D为CO2,
③C+D→A+B 为 3 NaOH+2CO2=NaHCO3+Na2CO3+H2O,④B A+D+H2O为:2NaHCO3(B)=Na2CO3+CO2+H2O,①A+D+H2O→B为:
A+D+H2O为:2NaHCO3(B)=Na2CO3+CO2+H2O,①A+D+H2O→B为:
Na2CO3(A)+CO2(D)+H2O=2NaHCO3(B),②B+C→A+H2O为:NaHCO3(B)+NaOH(C)=Na2CO3(A)+H2O,
故A是Na2CO3,D是CO2,
故答案为:Na2CO3;CO2;HCO3-+OH-=CO32-+H2O;3OH-+2CO2=HCO3-+CO32-+H2O;2NaHCO3=Na2CO3+CO2+H2O;
分析:(1)根据反应物、生成物、反应条件,和化学方程式的书写步骤正确书写化学方程式;
(2)钠浮在水面上;
(3)反应后生成氢氧化钠,溶液呈碱性;
(4)钠的密度比煤油的小,钠不与煤油反应;
(5)A、B、C均可溶于水,焰色反应均呈黄色说明均含有钠离子,C的溶液为碱溶液,C为NaOH,无色气体D为CO2;
点评:本题考查碱金属及其化合物的性质实验,难度适中,难点是(5),注意元素化合物知识的积累.
(2)钠浮在水面上说明钠的密度比水的小,故答案为:小;
(3)反应后生成氢氧化钠,溶液呈碱性,酚酞变红,故答案为:红;
(4)钠的密度比煤油的小,钠不与煤油反应,少量的钠可以保存在煤油中,故答案为:煤油;
(5)A、B、C均可溶于水,焰色反应均呈黄色说明均含有钠离子,C的溶液为碱溶液,C为NaOH,无色气体D为CO2,
③C+D→A+B 为 3 NaOH+2CO2=NaHCO3+Na2CO3+H2O,④B
 A+D+H2O为:2NaHCO3(B)=Na2CO3+CO2+H2O,①A+D+H2O→B为:
A+D+H2O为:2NaHCO3(B)=Na2CO3+CO2+H2O,①A+D+H2O→B为:Na2CO3(A)+CO2(D)+H2O=2NaHCO3(B),②B+C→A+H2O为:NaHCO3(B)+NaOH(C)=Na2CO3(A)+H2O,
故A是Na2CO3,D是CO2,
故答案为:Na2CO3;CO2;HCO3-+OH-=CO32-+H2O;3OH-+2CO2=HCO3-+CO32-+H2O;2NaHCO3=Na2CO3+CO2+H2O;
分析:(1)根据反应物、生成物、反应条件,和化学方程式的书写步骤正确书写化学方程式;
(2)钠浮在水面上;
(3)反应后生成氢氧化钠,溶液呈碱性;
(4)钠的密度比煤油的小,钠不与煤油反应;
(5)A、B、C均可溶于水,焰色反应均呈黄色说明均含有钠离子,C的溶液为碱溶液,C为NaOH,无色气体D为CO2;
点评:本题考查碱金属及其化合物的性质实验,难度适中,难点是(5),注意元素化合物知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 实验目的:探究过氧化钠与水反应后的溶液滴加酚酞试液先变红后退色的原因.
实验目的:探究过氧化钠与水反应后的溶液滴加酚酞试液先变红后退色的原因.【分析与猜想】
(1)根据过氧化钠与水反应的原理:2Na2O2+2H2O═4NaOH+O2↑,往过氧化钠固体完全溶解反应后的溶液中滴加酚酞本应只会变红而不会退色,而实验中发现酚酞变红后又退色.由此提出如下的猜想:
A.氧气有漂白性
B.氢氧化钠有漂白性
C.
【实验与判断】
请完成表格:
| 实验编号 | 1 | 2 | 3 |
| 实验装置 | 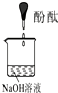 |
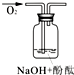 |
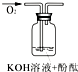 |
| 验证猜想 | C | ||
| 实验现象 | 溶液变红后不退色 | ||
| 实验说明 | 1、2的实验中NaOH溶液是用 | ||
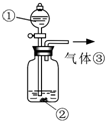
(3)可用如图装置对溶液中不很稳定的物质进行探究,在①处装入的物质是
A.酚酞试剂
B.过氧化钠与水反应后的溶液
C.二氧化锰
D.氢氧化钠固体配制的溶液
(4)气体③是
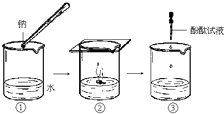 钠与水反应的过程如图所示.请回答:
钠与水反应的过程如图所示.请回答: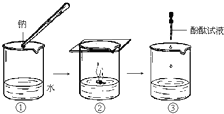
 A+D+H2O
A+D+H2O