题目内容
3.二氧化硫能使品红褪色,说明二氧化硫具有( )| A. | 还原性 | B. | 氧化性 | C. | 酸性 | D. | 漂白性 |
分析 二氧化硫能和有色物质反应生成无色物质而具有漂白性,二氧化硫还具有氧化性、还原性和酸性,据此分析解答.
解答 解:二氧化硫能和有色物质反应生成无色物质而具有漂白性,但二氧化硫漂白性具有暂时性特点,加热易恢复原色,二氧化硫能使品红溶液褪色体现二氧化硫漂白性,与二氧化硫还原性、氧化性、酸性无关,故选D.
点评 本题考查二氧化硫漂白性,为高频考点,注意二氧化硫能漂白品红溶液但不能漂白酸碱指示剂,题目难度不大.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
14.下列各组物质中,所含分子数相同的是( )
| A. | 10g H2 和10g O2 | B. | 5.6lL N2(标准状况下)和11gCO2 | ||
| C. | 9克H2O和0.5mol 02 | D. | 224mL H2(标准状况下)和0.1mol N2 |
8.下列反应的离子方程式正确的是( )
| A. | 氯化铝与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| B. | 铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氯气与水反应:Cl2+H2O?2H++Cl-+ClO- | |
| D. | 向苏打溶液中加入足量的醋酸:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- |
15.下列四组实验,根据实验事实得出的结论,正确的是( )
| A. | 在某未知试液中加入浓的NaOH溶液并加热,产生能使湿润的蓝色石蕊试纸变红的气体--原未知试液中一定含有NH4+ | |
| B. | 在某未知试液中加入硝酸银溶液,产生白色沉淀--原未知试液中一定含有Cl- | |
| C. | 用洁净的铂丝蘸取某溶液,置于火焰上灼烧,观察到火焰呈黄色--原溶液中一定含有Na+,不含有K+ | |
| D. | 在某未知试液中滴加过量的稀盐酸得到澄清溶液,再往澄清溶液中加入BaCl2溶液得白色沉淀--原未知试液中一定含有SO42- |
 命名为“2乙基丙烷”,错误原因是主链选错;将其命名为“3甲基丁烷”,错误原因是编号错误.正确的命名为2-甲基丁烷.
命名为“2乙基丙烷”,错误原因是主链选错;将其命名为“3甲基丁烷”,错误原因是编号错误.正确的命名为2-甲基丁烷.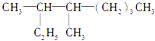 的名称是3,4-二甲基辛烷.
的名称是3,4-二甲基辛烷.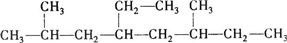 ,1mol该烷烃完全燃烧需消耗氧气18.5mol.
,1mol该烷烃完全燃烧需消耗氧气18.5mol.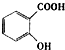 )可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式:
)可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式: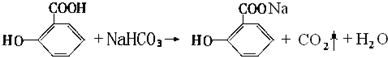 .
.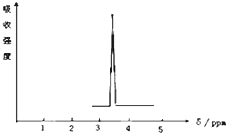 在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值可以确定有机物分子中氢原子的种类和数目
在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值可以确定有机物分子中氢原子的种类和数目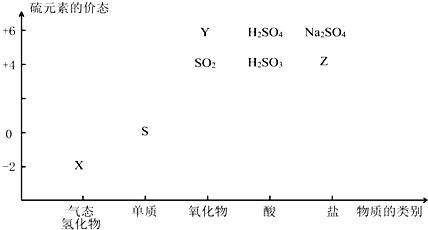
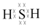 ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱(填“强”或“弱”).用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多原子半径增大,得电子能力逐渐减弱.
;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱(填“强”或“弱”).用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多原子半径增大,得电子能力逐渐减弱.