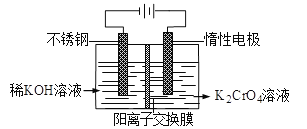
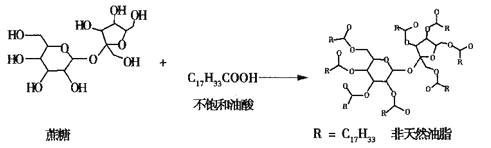
题目内容
【题目】设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A. 常温常压下,11.2 L氧气所含的原子数为NA
B. 1.8 g的NH4+离子中含有的质子数为NA
C. 常温常压下,48 g O3和O2的混合物含有的氧原子数为3NA
D. 2.4 g金属镁变为镁离子时失去的电子数为0.1NA
【答案】C
【解析】A.不是标况下,不能使用标况下的气体摩尔体积计算11.2L氧气的物质的量,故A错误;B.1.8g铵根离子的物质的量为: ![]() =0.1mol,0.1mol铵根离子中含有1.1mol质子,含有的质子数为1.1NA,故B错误;C.48gO3和O2的混合物中含有48g氧原子,含有氧原子的物质的量为:
=0.1mol,0.1mol铵根离子中含有1.1mol质子,含有的质子数为1.1NA,故B错误;C.48gO3和O2的混合物中含有48g氧原子,含有氧原子的物质的量为: ![]() =3mol,含有氧原子数为3NA,故C正确;D.2.4g镁的物质的量为:
=3mol,含有氧原子数为3NA,故C正确;D.2.4g镁的物质的量为: ![]() =0.1mol,0.1mol镁变成镁离子失去0.2mol电子,失去的电子数为0.2NA,故D错误;故选C。
=0.1mol,0.1mol镁变成镁离子失去0.2mol电子,失去的电子数为0.2NA,故D错误;故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】为了提纯下表所列物质(括号内为杂质),有关除杂试剂和分离方法的选择不正确的是
选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
A | 乙烷(乙烯) | KMnO4溶液 | 洗气 |
B | 粗苯甲酸(泥沙) | 水 | 重结晶 |
C | CH3CH2OH(CH3COOH) | CaO | 蒸馏 |
D | 肥皂(甘油) | NaCl | 过滤 |
A.AB.BC.CD.D
【题目】某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。
【实验Ⅰ】试剂:酸化的0.5 mol·L-1FeSO4溶液(pH = 0.2),5% H2O2溶液(pH = 5)
操作 | 现象 |
取2mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液pH=0.9 |
向反应后的溶液中加入KSCN溶液 | 溶液变红 |
(1)H2O2的电子式是_______,上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是________。
(2)产生气泡的原因是____________________。
【实验Ⅱ】 试剂:未酸化的0.5 mol·L-1FeSO4溶液(pH = 3),5% H2O2溶液(pH = 5)
操作 | 现象 |
取2 mL5% H2O2溶液于试管中,加入5滴上述FeSO4溶液 | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊。测得反应后溶液pH=1.4 |
(3)将上述混合物分离,得到棕黄色沉淀和红褐色胶体。取部分棕黄色沉淀洗净,加4mol·L-1盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有Fe2O3,经检验还含有SO42-。检验棕黄色沉淀中SO42-的方法是________。
(4)对于生成红褐色胶体的原因,提出两种假设:
i.H2O2溶液氧化Fe2+消耗H+
ii.Fe2+ 氧化的产物发生了水解
① 根据实验II记录否定假设i,理由是________。
② 实验验证假设ii:取Fe2(SO4)3溶液加热,溶液变为红褐色,pH下降,证明假设ii成立。
(5)将FeSO4溶液加入H2O2溶液后,产生红褐色胶体,反应的离子方程式是________。
【实验Ⅲ】
若用FeCl2溶液替代FeSO4溶液,其余操作与实验II相同,除了产生与II相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(6)产生刺激性气味气体的原因是________。
(7)由实验Ⅰ、Ⅱ、Ⅲ可知,亚铁盐与H2O2反应的现象与________(至少写两点)有关。