题目内容
15.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 42g乙烯和丙烯的混合气体中碳原子数目一定为3NA. | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液复原,则电解时产生标准状况下1.12L的气体 | |
| C. | 配制一定物质的量浓度的NaOH溶液,把NaOH固体于烧杯中充分溶解,并迅速转移到容量瓶中定容 | |
| D. | 30g的NO与O2充分反应后,生成的气体分子数为1NA. |
分析 A.乙烯和丙烯的最简式为CH2,根据最简式进行计算;
B.没有告诉在标准状况下,无法计算电解生成气体的体积;
C.溶解后的氢氧化钠溶液必须冷却后才能转移到容量瓶中,否则影响配制结果;
D.30NO的物质的量为1mol,1mol一氧化氮与氧气反应生成1mol二氧化氮,由于部分二氧化氮转化成四氧化二氮,则生成物的物质的量小于1mol.
解答 解:A.42g乙烯和丙烯的混合物中含有42g最简式CH2,含有最简式的物质的量为:$\frac{42g}{14g/mol}$=3mol,则混合物中含有3mol碳原子,混合气体中碳原子数目一定为3NA,故A正确;
B.不是标况下,不能使用标况下的气体摩尔体积计算气体体积,故B错误;
C.氢氧化钠溶于水放出热量,必须冷却后再转移到容量瓶,故C错误;
D.30gNO的物质的量为:$\frac{30g}{30g/mol}$=1mol,1molNO与氧气完全反应生成1mol二氧化氮,由于部分部分二氧化氮转化成四氧化二氮,则生成物的物质的量小于1mol,生成的气体分子数小于NA,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系.

练习册系列答案
相关题目
5.下列化学式中,能真实表示物质的分子组成的是( )
| A. | CuSO4 | B. | CS2 | C. | Ar | D. | CsCl |
6.我国有丰富的天然气资源.以天然气为原料合成尿素的主要步骤如图所示(图中某些转化步骤及生成物未列出):

(1)“造合成气”发生的热化学方程式是CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0在恒温恒容的条件下,欲提高CH4的反应速率和转化率,下列措施可行的是BD.
A、增大压强 B、升高温度 C、充入He气 D、增大水蒸气浓度
(2)“转化一氧化碳”发生的方程式是H2O(g)+CO(g)?H2(g)+CO2(g),该反应平衡常数随温度的
变化如下:
提高氢碳比[$\frac{n({H}_{2}O)}{n(CO)}$],K值不变(填“增大”、“不变”或“减小”);若该反应在400℃时进行,起始通入等物质的量的H2O和CO,反应进行到某一时刻时CO和CO2的浓度比为1:3,此时v(正)>v(逆)(填“>”、“=”或“<”).
(3)有关合成氨工业的说法中正确的是A.
A、该反应属于人工固氮
B、合成氨工业中使用催化剂能提高反应物的利用率
C、合成氨反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D、合成氨工业采用循环操作的主要原因是为了加快反应速率
(4)生产尿素过程中,理论上n(NH3):n(CO2)的最佳配比为2:1,而实际生产过程中,往往使n(NH3):n(CO2)≥3,这是因为有利于提高CO2的转化率,因为NH3极易溶于水,便于分离、回收利用.
(5)当甲烷合成氨气的转化率为60%时,以3.0×108L甲烷为原料能够合成4.8×108L 氨气.(假设体积均在标准状况下测定)

(1)“造合成气”发生的热化学方程式是CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0在恒温恒容的条件下,欲提高CH4的反应速率和转化率,下列措施可行的是BD.
A、增大压强 B、升高温度 C、充入He气 D、增大水蒸气浓度
(2)“转化一氧化碳”发生的方程式是H2O(g)+CO(g)?H2(g)+CO2(g),该反应平衡常数随温度的
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
提高氢碳比[$\frac{n({H}_{2}O)}{n(CO)}$],K值不变(填“增大”、“不变”或“减小”);若该反应在400℃时进行,起始通入等物质的量的H2O和CO,反应进行到某一时刻时CO和CO2的浓度比为1:3,此时v(正)>v(逆)(填“>”、“=”或“<”).
(3)有关合成氨工业的说法中正确的是A.
A、该反应属于人工固氮
B、合成氨工业中使用催化剂能提高反应物的利用率
C、合成氨反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D、合成氨工业采用循环操作的主要原因是为了加快反应速率
(4)生产尿素过程中,理论上n(NH3):n(CO2)的最佳配比为2:1,而实际生产过程中,往往使n(NH3):n(CO2)≥3,这是因为有利于提高CO2的转化率,因为NH3极易溶于水,便于分离、回收利用.
(5)当甲烷合成氨气的转化率为60%时,以3.0×108L甲烷为原料能够合成4.8×108L 氨气.(假设体积均在标准状况下测定)
10.下列有关说法错误的是( )
| A. | 已知氯化钴及其水合物会呈现不同颜色(如下),德国科学家发明了添加氯化钴的变色水泥,据此推测雨天变色水泥呈粉红色 | |
| B. | 已知铬酸根(黄色)和重铬酸根(橙色)离子间存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O,若加水稀释,则溶液中所有离子浓度均减少 | |
| C. | 若反应2A(g)+B(s)?C(g)+3D(g)只有高温下才能自发进行,则该反应的△H>0 | |
| D. | 增大反应物的浓度,可使单位体积内活化分子数目增多,反应速率加快 |
20.如表为元素周期表前四周期的一部分,下列有关A、B、C、D、E、F六种元素的叙述正确的是( )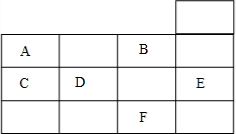

| A. | 常压下六种元素的单质中,F单质的沸点最高 | |
| B. | 晶体E中不存在化学键 | |
| C. | D元素的非金属性比B元素的非金属性强 | |
| D. | 单质A、C均没有同素异形体 |
7.下列化学用语表述正确的是( )
| A. | 羟基的电子式: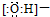 | B. | 硫原子的原子结构示意图: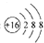 | ||
| C. | 乙烯分子的实验式:C2H4 | D. | 3,3一二甲基一1一戊烯的键线式: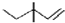 |
4.下列说法正确的是( )
| A. | 所有自发进行的化学反应都是放热反应 | |
| B. | 同一物质固、液、气三种状态的熵值相同 | |
| C. | △H<0、△S>0的反应可自发进行 | |
| D. | 在其他条件不变的情况下,使用催化剂可以改变化学反应进行的方向 |
 甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题: