题目内容
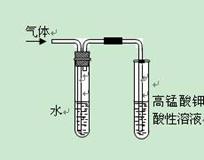
用下图装置进行实验,将A逐滴加入B中:
(1)若A为浓H2SO4,B为第三周期金属元素的片状单质,其在常温下难与水反应,C为品红溶液,实验中观察到溶液褪色,则B是________(填化学式),B与浓H2SO4反应的化学方学方程式为________.反应后往烧杯中加入沸水,又可观察到试管C中的现象为________.
(2)若B为Na2Co3,C为C6H5ONa溶液,实验中观察到小试管内溶液变浑浊,则酸A应具有的性质是________.然后往烧杯中加入沸水,可观察到试管C中的现象是____________.
答案:
解析:
解析:
|
(10分,每空2分) (1)Mg Mg+2H2SO4(浓)=MgSO4+SO2↑+2H2O C中溶液变红 (2)酸性比碳酸的酸性强 溶液由浑浊变澄清 |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某小组同学用下图装置进行实验研究(a、b、c表示止水夹).请评价或完善其方案:
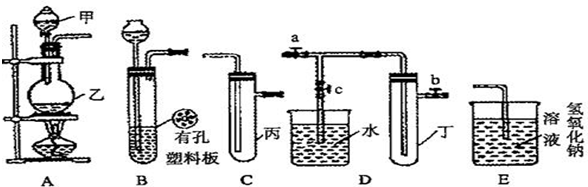
(1)用MnO2和浓盐酸制取氯气,将A、C、E相连,A中反应的离子方程式 .E中氢氧化钠溶液的作用 .
在丙中加入适量水可制得氯水.将所得氯水分成两份,进行实验,其操作、现象、结论为:
①实验I推出的相应结论是否合理? ,若不合理,请说明理由(若合理,无需填写): .
②实验II 推出的相应结论是否合理? ,若不合理,请说明理由(若合理,无需填写): .
(2)为比较Cl2和I2的氧化性强弱,将A、C、E相连,C中盛的试剂可以为 .
(3)将B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验.
①B中发生反应的离子方程式为 .
②若关闭止水夹a、b,打开c,双手紧握(或微热)试管丁,使其中的NO2逸出进入D中,丁中可以观察到的现象 .

(1)用MnO2和浓盐酸制取氯气,将A、C、E相连,A中反应的离子方程式
在丙中加入适量水可制得氯水.将所得氯水分成两份,进行实验,其操作、现象、结论为:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
②实验II 推出的相应结论是否合理?
(2)为比较Cl2和I2的氧化性强弱,将A、C、E相连,C中盛的试剂可以为
(3)将B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验.
①B中发生反应的离子方程式为
②若关闭止水夹a、b,打开c,双手紧握(或微热)试管丁,使其中的NO2逸出进入D中,丁中可以观察到的现象
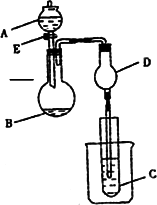
 完成以下实验:①用右图所示的装置制取溴乙烷;②进行溴乙烷的性质实验.在试管I中依次加入2mL 蒸馏水、4mL浓硫酸、2mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管I至微沸状态数分钟后,冷却.
完成以下实验:①用右图所示的装置制取溴乙烷;②进行溴乙烷的性质实验.在试管I中依次加入2mL 蒸馏水、4mL浓硫酸、2mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管I至微沸状态数分钟后,冷却.