题目内容
【题目】下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质。反应①②均为工业上的重要反应。
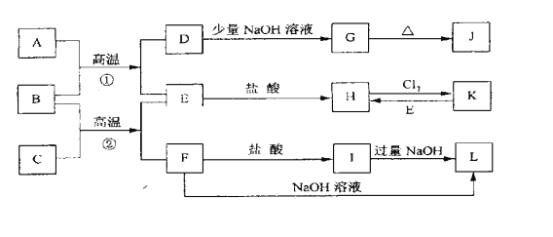
请回答下列问题:
(1)写出下列物质的化学式:D___________;K____________;L______________。
(2)写出B与C高温反应生成E和F的化学方程式:_______________________。
(3)写出D与J的稀溶液反应生成G的离子方程式:______________________。
(4)写出H转化为K的离子方程式:______________________。
【答案】CO2 FeCl3 NaAlO2 2Al+Fe2O3![]() 2Fe+Al2O3 CO32-+H2O+CO2=2HCO3- 2Fe2+ +Cl2=2Fe3++2Cl-
2Fe+Al2O3 CO32-+H2O+CO2=2HCO3- 2Fe2+ +Cl2=2Fe3++2Cl-
【解析】
常温常压下,B为红棕色粉末,则B为Fe2O3,A为无色有毒气体,结合转化关系,可推知A具有还原性,故A为CO,则D为CO2,E为Fe,G为NaHCO3,J为Na2CO3,H为FeCl2,K为FeCl3,金属C与氧化铁反应生成Fe和F,F为金属氧化物,既与盐酸反应又能与氢氧化钠反应,则F为Al2O3,C为Al,I为AlCl3,L为NaAlO2,据此答题。
(1)由分析可知D为CO2,K为FeCl3,L为NaAlO2,故答案为:CO2,FeCl3,NaAlO2。
(2)铝与氧化铁在高温条件下生成铁和氧化铝,反应方程式为:2Al+Fe2O3![]() 2Fe+Al2O3,故答案为:2Al+Fe2O3
2Fe+Al2O3,故答案为:2Al+Fe2O3![]() 2Fe+Al2O3。
2Fe+Al2O3。
(3)二氧化碳与碳酸钠溶液反应生成碳酸氢钠,反应的离子方程式为:CO32-+H2O+CO2=2HCO3-,故答案为:CO32-+H2O+CO2=2HCO3-。
(4)氯化亚铁与氯气反应生成氯化铁,反应的离子方程式为:2Fe2+ +Cl2=2Fe3++2Cl-,故答案为:2Fe2+ +Cl2=2Fe3++2Cl-。

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案【题目】用下图装置进行①中实验,对应②中现象正确,且能达成相应实验目的的是( )
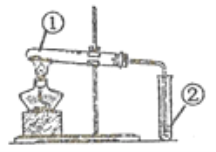
选项 | ①中实验 | ②中现象 | 实验目的 |
A | 将浸透石蜡油的石棉加热 | Br2的CCl4溶液褪色 | 石蜡裂解产物中含有烯烃 |
B | 加热NH4Cl固体 | 酚酞溶液变红 | 制备氨气并检验氨气性质 |
C | 加热NaHCO3与Na2CO3混合粉末 | 澄清石灰水变浑浊 | 验证NaHCO3具有热不稳定性 |
D | 加热铁粉及湿棉花 | 肥皂水中有气泡冒出 | Fe与H2O发生了置换反应 |
A. A B. B C. C D. D