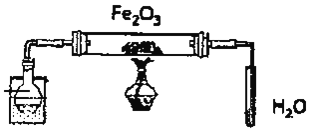题目内容
【题目】草酸(H2C2O4)是一种重要的有机化工原料,为探究草酸的制取和草酸的性质,进行如下实验:
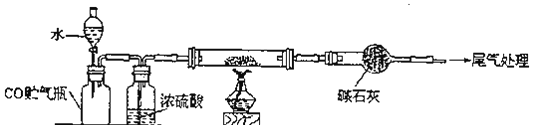
实验Ⅰ:实验室用硝酸氧化淀粉水解液法制备草酸,装置如图所示:
①一定量的淀粉水解液加入三劲烧瓶中
②控制反应温度55~60℃,边搅拌边缓慢滴加一定量的混合酸(65%的H2SO4与98%的H2SO4的质量比为2:1.25)
③反应3小时,冷却,有随后再重结晶得到草酸晶体硝酸氧化淀粉水解液的反应为:C6H12O6+12HNO3=3H2C2O4+9NO2↑+3NO↑+9H2O
(1)装置B的作用是 ______
(2)如何检验该装置的气密性: ______
(3)要控制反应温度55~60℃,应选择加热的方式是 ______,C装置中应加入 ______溶液。
实验Ⅱ:探究草酸与酸性高锰酸钾的反应
(4)向草酸溶液中逐滴加硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,写出上述反应的离子方程式:______
(5)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快,为探究其原因,同学们做了如下对比实验:
实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(s) 质量(g) | 褪色时间(g) | ||
c(mol/L) | V(mL) | c(mol/L) | V(mL) | |||
实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
由此你认为溶液褪色总是先慢后快的原因是 ______
(6)为测定上述实验中得到草酸的纯度,取5.0 g该草酸样品,配制成250 mL溶液,然后取25.00 mL此溶液溶于锥形瓶中,将0.10 mol/L酸性KMnO4溶液装在 ______(填仪器名称)中进行滴定,达到滴定终点时的现象是 ______,若消耗酸性KMnO4溶液体积为20.00 mL,则该草酸样品的纯度为 ______。
【答案】安全瓶(或防止C中液体倒吸进A中) 关闭装置A中分液漏斗甲的活塞,将C中导管口插入烧杯中的水中,用酒精灯稍微加热三颈烧瓶,若导管口产生气泡,冷却后,导管中产生一段稳定的水柱,就证明装置气密性良好 水浴加热 NaOH 5H2C2O4+6H++2MnO4-=2Mn2++10CO2↑+8H2O 生成的Mn2+对此反应起催化剂的作用 酸式滴定管 溶液由无色变为紫色,且半分钟不褪色 ![]()
【解析】
I.淀粉在硫酸存在和加热条件下发生水解反应产生葡萄糖,葡萄糖与浓硝酸发生氧化还原反应产生草酸,同时反应产生NO、NO2气体,装置B为安全瓶,可以防止NO、NO2气体被NaOH溶液吸收时产生的倒吸现象的发生;
II.草酸具有还原性,可以被酸性高锰酸钾溶液氧化为CO2气体,酸性高锰酸钾被还原为无色Mn2+;因此会看到溶液有紫色变为无色,若滴定完全,溶液会变为紫色,半分钟内不褪色;根据对比实验的异同,结合影响化学反应速率的因素分析速率变化的原因;根据仪器的结构、物质的性质判断仪器的使用,根据氧化还原反应中电子守恒计算物质纯度。
(1)反应中生成的NO2、NO能够与NaOH溶液反应生成NaNO2,容易发生倒吸现象,装置B为安全瓶,可以防止C中液体倒吸入反应装置A中;
(2)检验该装置的气密性方法为:关闭A装置中分液漏斗甲的活塞,将C中导管口插入烧杯中的水中,用酒精灯稍微加热三颈烧瓶,若导管口产生气泡,冷却后,导管中产生一段稳定的水柱,就证明装置气密性良好;
(3)要控制反应温度55~60℃,应选择加热的方式是水浴加热;反应生成的气体为NO2、NO,二者都是有毒气体,需要使用尾气吸收装置,NO2、NO能够与氢氧化钠溶液反应生成NaNO2,所以C中的液体可以为NaOH溶液;
(4)酸性高锰酸钾具有强氧化性,草酸能够被氧化为二氧化碳,导致酸性高锰酸钾溶液褪色,反应的离子方程式为:5H2C2O4+6H++2MnO4-=2Mn2++10CO2↑+8H2O;
(5)通过两组实验比较知,其它条件相同,试验2中加入硫酸锰,其反应时间短,说明反应速率快,从而证明反应生成的Mn2+有催化作用,加快了反应速率;
(6)酸性高锰酸钾溶液具有强氧化性,会腐蚀碱式滴定管的橡胶管,所以不能用碱式滴定管盛放,应该选用酸式滴定管盛放酸性高锰酸钾溶液;滴定过程中,高锰酸根离子完全反应变为Mn2+,溶液为无色,草酸完全反应后,高锰酸根离子过量,使溶液呈紫色,所以滴定终点的现象为:溶液由无色变为紫色,且半分钟不褪色;20 mL0.1 mol/L的高锰酸钾的物质的量n(KMnO4)=c·V=0.1 mol/L×0.02 L=0.002 mol,根据反应55H2C2O4+6H++2MnO4-=2Mn2++10CO2↑+8H2O可知,5.0 g该草酸样品中含有草酸的物质的量n(H2C2O4)=0.002 mol×![]() ×
×![]() =0.002 mol×
=0.002 mol×![]() ×
×![]() =0.05 mol,所以该样品中草酸的纯度为:
=0.05 mol,所以该样品中草酸的纯度为:![]() ×100%=90%。
×100%=90%。

【题目】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法不正确的是( )
A.升温不利于正反应生成Ni(CO)4(g)
B.在25 ℃时,反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10-5
C.在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v正>v逆
D.在80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol·L-1