题目内容
向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是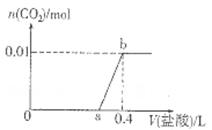
| A.在0-a范围内,只发生中和反应 |
| B.ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑ |
| C.a=0.3 |
| D.原混合溶液中NaOH与Na2CO3的物质的量之比为1:2 |
C
解析试题分析: 向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸发生的反应依次为H++OH-=H2O、CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑,据此可以解答。A、在0-a范围内,发生的反应应该是H++OH-=H2O、CO32-+H+=HCO3-、,不止有中和反应,A不正确;B、ab段发生反应的离子方程式为HCO3-+H+=H2O+CO2↑,B不正确;C、生成CO2的物质的量是0.1mol,则根据方程式HCO3-+H+=H2O+CO2↑可知,消耗盐酸的物质的量是0.1mol,所以a=0.3,C正确;D、根据方程式和图像可知碳酸钠的物质的量是0.1mol,共计消耗盐酸是0.2mol,所以与氢氧化钠反应的盐酸是0.4mol-0.2mol=0.2mol,则氢氧化钠的物质的量是0.2mol,因此原混合溶液中NaOH与Na2CO3的物质的量之比为2:1,D不正确,答案选C。
考点:考查氢氧化钠、碳酸钠与盐酸反应的有关计算以及图像分析与判断

向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入c mol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系正确的是
A.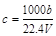 | B.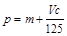 | C.n=m+17Vc | D.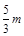 <p< <p<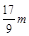 |
等量的铝,分别与足量的盐酸和氢氧化钠溶液充分反应,放出的氢气在同温同压下的体积比为
| A.1:3 | B.1:6 | C.1:1 | D.2:3 |
请分别选用一种试剂(写名称)除去下列物质中的杂质,并写出相应的化学方程式。
| | 物质 | 杂质 | 所选试剂名称 | 化学方程式 |
| ① | NaHCO3溶液 | Na2CO3 | | |
| ② | Mg粉 | Al 粉 | | |
| ③ | FeCl3溶液 | FeCl2 | | |
FeS2的结构类似于Na2O2,是一种过硫化物,与酸反应时生成H2S2,H2S2易分解。实验室用稀硫酸与FeS2颗粒混合,则反应完毕后不可能生成的物质是
| A.H2S | B.S | C.FeS | D.FeSO4 |
为鉴别K2CO3和NaHCO3两种白色固体,有4位同学分别设计了以下四种不同的方案,其中方法和现象判断不正确的是
| A.用铂丝粘取固体在酒精灯火焰上灼烧,观察火焰的颜色 |
| B.分别取样配成溶液,滴加CaCl2溶液,观察有无白色沉淀 |
| C.分别加入1mol/L的盐酸溶液,看有无气泡产生 |
| D.分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊 |
将amol小苏打和bmol过氧化钠置于某体积可变的密闭容器中充分加热,反应后测得容器内的氧气为1mol,下列说法一定正确的是
| A.b=2 | B.容器中一定没有残余的CO2和水蒸气 |
| C.a:b≥1 | D.反应中转移的电子数一定为2NA |
把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液。过滤出沉淀,洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则原合金中铁的质量分数为( )
| A.70% | B.52.4% | C.47.6% | D.30% |
下列说法错误的是
| A.仅用KSCN可以检验Fe2+ | B.可以用NaOH溶液检验Fe3+ |
| C.通过化合反应可以得到Fe(OH)3 | D.通过化合反应可以得到FeCl2 |