题目内容
【题目】计算机记忆材料生产中产生大量的钌废料,一种从钌废料[含Ru(OH)3、FeO、MnO、SiO2及少量的Au]中合成六氯钌酸铵[(NH4)2RuCl6]的流程如下:
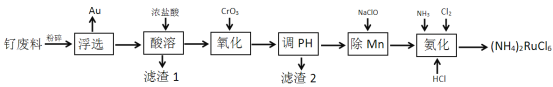
回答下列问题
(1)(NH4)2RuCl6中Ru的化合价为___________。
(2)滤渣1的成分是________ 。
(3)加入CrO3发生反应的离子方程式为______________ 。
(4)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如下表,调pH时,应调整的pH范围为_________。
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.8 | 3.2 |
Cr3+ | 4.6 | 5.9 |
Fe2+ | 5.8 | 11.2 |
Mn2+ | 8.8 | 10.9 |
Ru3+ | 7.9 | 11.3 |
(5)加入NaClO后,Mn以MnO2的形式沉淀而除去,该反应中氧化剂与还原剂的物质的量之比为________。
(6)氨化时发生反应的化学方程式为____________
(7)氨化时,投料比![]() 对(NH4)2RuCl6产率的影响如图所示:
对(NH4)2RuCl6产率的影响如图所示:
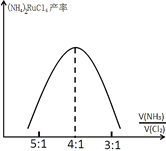
(NH4)2RuCl6的产率在![]() 为4:1后降低,其原因可能是_______________。
为4:1后降低,其原因可能是_______________。
(8)已知钌废料中钌含量为53%,氨化时产率为91%,其余步骤损失率合计为11%,则2吨钌废料可制得(NH4)2RuCl6________Kg。
【答案】+4 SiO2 CrO3+3Fe2++6H+=Cr3++3Fe3++3H2O 5.9≤pH<7.9 1:1 2RuCl3+Cl2 +4NH3 +4HCl=2(NH4)2RuCl6 ![]() 后,Cl2过量,Cl2把Ru4+氧化成更高价 2975
后,Cl2过量,Cl2把Ru4+氧化成更高价 2975
【解析】
(1)根据化合物的整体化合价为0。
(2)与浓盐酸不反应的只有SiO2。
(3)CrO3氧化Fe2+进行配平离子方程式。
(4)调pH时,主要目的是除去Cr3+、Fe3+,根据表中离子沉淀的pH值分析。
(5)加入NaClO后,主要是锰离子与次氯酸根反应。
(6)氨水生成(NH4)2RuCl6,再进行配平。
(7) Cl2过量,可能是Cl2把Ru4+氧化成更高价。
(8)根据损失量、摩尔质量得到答案。
(1)化合物的整体化合价为0,根据化合价分析得到Ru为+4,故答案为:+4。
(2)钌废料中与浓盐酸不反应的只有SiO2,所以滤渣1的成分是SiO2,故答案为:SiO2。
(3)CrO3氧化Fe2+,配平后离子方程式为CrO3+3Fe2++6H+=Cr3++3Fe3++3H2O,故答案为:CrO3 + 3Fe2++6H+=Cr3++3Fe3++3H2O。
(4)调pH时,主要目的是除去Cr3+、Fe3+,根据表中离子沉淀的pH,应调整的pH范围为5.9≤pH<7.9,故答案为:5.9≤pH<7.9。
(5)加入NaClO后,主要是锰离子与次氯酸根反应,其发生的离子反应为H2O+ClO-+Mn2+ = Cl-+MnO2↓+2H+,反应中氧化剂与还原剂的物质的量之比为1:1,故答案为:1:1。
(6)氨水生成(NH4)2RuCl6,配平后得2RuCl3+Cl2 +4NH3 +4HCl=2(NH4)2RuCl6,故答案为:2RuCl3+Cl2 +4NH3 +4HCl=2(NH4)2RuCl6。
(7) ![]() 后,Cl2过量,可能是Cl2把Ru4+氧化成更高价,故答案为:
后,Cl2过量,可能是Cl2把Ru4+氧化成更高价,故答案为:![]() 后,Cl2过量,Cl2把Ru4+氧化成更高价。
后,Cl2过量,Cl2把Ru4+氧化成更高价。
(8)m[(NH4)2RuCl6]= ![]() =2975Kg,故答案为:2975。
=2975Kg,故答案为:2975。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应