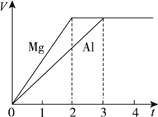
题目内容
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液。其导电能力随滴入溶液体积变化的曲线如下图所示。请回答下列问题。
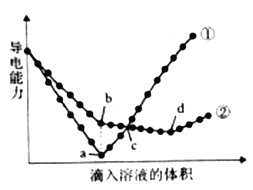
(1)写出NaHSO4溶液中,NaHSO4的电离方程式________。
(2)图中①、②分别代表滴加哪种溶液的变化曲线①_______、②______。
(3)b点,溶液中大量存在的离子是______ 。
(4)a、d两点对应的溶液均显______ (填“酸性“中性”或“碱性”)。
(5)曲线②中d点导电能力最弱的原因是______ (用化学方程式表示)。
(6)c点,两溶液中含有相同量的哪种离子______。
【答案】 NaHSO4=Na++H++SO42- H2SO4 NaHSO4 Na+、OH– 中性 Ba(OH)2+2NaHSO4=BaSO4↓+Na2SO4+2H2O SO42–
【解析】试题分析:本题考查电离方程式的书写和符合条件的化学方程式的书写,溶液导电性的分析,图像分析。
(1)NaHSO4属于强酸的酸式盐,在水溶液中的电离方程式为:NaHSO4=Na++H++SO42-。
(2)Ba(OH)2溶液中导电离子为Ba2+、OH-。若向Ba(OH)2溶液中滴加H2SO4溶液,发生离子反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,BaSO4难溶于水,H2O难电离,溶液中离子浓度减小,溶液导电能力减弱;当两者恰好完全反应时,溶液中离子浓度接近0,导电能力接近0;继续加H2SO4,溶液中离子浓度又增大,导电能力又增强,曲线①表示此过程,曲线①代表加入H2SO4溶液。若向Ba(OH)2溶液中滴加NaHSO4溶液,开始Ba(OH)2过量,发生的反应为:Ba(OH)2+NaHSO4=BaSO4↓+NaOH+H2O,BaSO4难溶于水,H2O难电离,溶液中离子浓度减小,溶液导电能力减弱;当Ba2+恰好完全沉淀时,溶液中溶质为NaOH,此时Na+、OH-导电;继续加入NaHSO4,发生反应NaOH+NaHSO4=Na2SO4+H2O,NaOH完全消耗时导电能力最小;继续加入NaHSO4溶液,溶液中离子浓度增大,导电能力又增强;曲线②表示此过程,曲线②表示表示加入NaHSO4溶液。
(3)根据上述分析,b点表示向Ba(OH)2溶液中加入NaHSO4溶液至Ba2+恰好完全沉淀,反应的化学方程式为:Ba(OH)2+NaHSO4=BaSO4↓+NaOH+H2O,此时溶液中大量存在的离子是Na+、OH-。
(4)a点表示Ba(OH)2溶液与H2SO4溶液恰好完全反应,反应的化学方程式为:Ba(OH)2+H2SO4=BaSO4↓+2H2O,此时溶液呈中性。d点表示Ba(OH)2溶液中加入NaHSO4溶液OH-完全中和,反应的化学方程式为:Ba(OH)2+2NaHSO4=BaSO4↓+2H2O+Na2SO4,此时溶液呈中性。a、d点对应的溶液均呈中性。
(5)曲线②中d点溶液中离子浓度最小,导电能力最弱,反应的化学方程式为:Ba(OH)2+2NaHSO4=BaSO4↓+2H2O+Na2SO4。
(6)a、b点表示加入的溶液将Ba2+完全沉淀;c点加入的溶液的体积大于a、b点,c点表示向两份相同的Ba(OH)2溶液中加入物质的量浓度相等的等体积的H2SO4和NaHSO4溶液,等体积等浓度的H2SO4和NaHSO4溶液SO42-相等、H+不相等,Ba2+消耗的SO42-相同,则两溶液中剩余的SO42-的量相同。