题目内容
将含有2.05 g某高价含氧酸的钙盐的溶液A与含1.20 g碳酸盐的溶液B混合,恰好完全反应,生成1.25 g白色沉淀C。将滤去沉淀C的滤液蒸发,得到白色固体D,继续加热D时,D分解只得两种气态物质的混合物,在0 ℃、1×105 Pa下,体积变为0.56 L,并得到0.90 g液态水,另一种气态物质为气态氧化物R2O。试回答:
(1)白色沉淀C的物质的量为________mol。
(2)A的摩尔质量为__________,B的摩尔质量为__________。
(3)R2O与H2O的物质的量之比为__________,生成D的质量为________,D的摩尔质量为________,R2O的相对分子质量为________,R2O的化学式是____________。
(4)写出A和B混合的化学方程式_____________________________________________。
(1)白色沉淀C的物质的量为________mol。
(2)A的摩尔质量为__________,B的摩尔质量为__________。
(3)R2O与H2O的物质的量之比为__________,生成D的质量为________,D的摩尔质量为________,R2O的相对分子质量为________,R2O的化学式是____________。
(4)写出A和B混合的化学方程式_____________________________________________。
:由A+B=C+D知,C为CaCO3,D是一种含三种元素的含氧酸盐,该盐只能是NH4NO3,分解生成的R2O为N2O。A为Ca(NO3)2,B为(NH4)2CO3。
(1)C的物质的量为1.25 g÷100 g·mol-1=0.012 5 mol。
(2)A、B的摩尔质量分别为164 g·mol-1和96 g·mol-1。
(3)N2O的物质的量为0.56 L÷22.4 L·mol-1=0.025 mol, N2O与H2O的物质的量之比为1∶2。
答案:(1)0.012 5 (2)164 g·mol-1 96 g·mol-1
(3)1∶2 2 g 80 g·mol-1 44 N2O
(4)Ca(NO3)2+(NH4)2CO3=CaCO3↓+2NH4NO3
(1)C的物质的量为1.25 g÷100 g·mol-1=0.012 5 mol。
(2)A、B的摩尔质量分别为164 g·mol-1和96 g·mol-1。
(3)N2O的物质的量为0.56 L÷22.4 L·mol-1=0.025 mol, N2O与H2O的物质的量之比为1∶2。
答案:(1)0.012 5 (2)164 g·mol-1 96 g·mol-1
(3)1∶2 2 g 80 g·mol-1 44 N2O
(4)Ca(NO3)2+(NH4)2CO3=CaCO3↓+2NH4NO3

练习册系列答案
相关题目
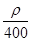 mol·L-1
mol·L-1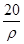 mol·L-1
mol·L-1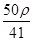 mol·L-1
mol·L-1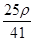 mol·L-1
mol·L-1

 (4)含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
(4)含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.

 (碳正离子)中含有的电子数为10NA
(碳正离子)中含有的电子数为10NA