题目内容
|
已知常温下:Ksp(Mg(OH)2〕=1.2×10-11 mol3·L-3 Ksp(AgCl)=1.8×10-10 mol2·L-2 Ksp(Ag2CrO4)=1.9×10-12 mol3·L-3,Ksp(CH3COOAg)=2.3×10-3 mol2·L-2下列叙述正确的是 | |
A. |
等体积混合浓度均为0.2 mol·L-1的AgNO3溶液和CH3COONa溶液一定产生CH3COOAg沉淀 |
B. |
将0.001 mol·L-1的AgNO3溶液滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4溶液中先产生Ag2CrO4沉淀 |
C. |
在Mg2+为0.121 mol·L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH至少要控制在9以上 |
D. |
向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)变大 |
答案:AC
解析:
解析:
|
A选项,c(Ag+)·c(CH3COO-)=0.2/2×0.2/2=0.01>Ksp(CH3COOAg),所以一定能生成沉淀.B选项,由Ksp(AgCl)和Ksp(Ag2CrO4)可知,溶解度S(AgCl)<S(Ag2CrO4),应该先有AgCl沉淀.C选项中,根据Ksp(Mg(OH)2〕=1.2×10-11可算出OH-浓度应大于10-5 mol·L-1,所以溶液的pH至少要控制在9以上.D选项,Ksp(AgCl)只与温度有关. |

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
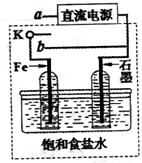 (2013?淄博二模)海水是丰富的资源宝库,从海水中提取元素是化学工业的重要组成部分.
(2013?淄博二模)海水是丰富的资源宝库,从海水中提取元素是化学工业的重要组成部分.