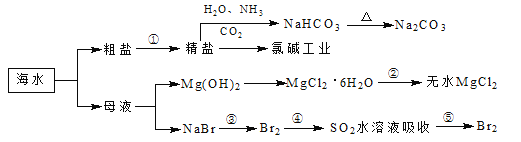
题目内容
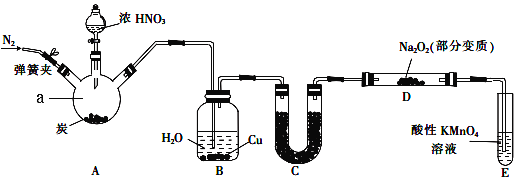
【题目】(14分)亚硝酸钠(NaNO2)是一种常见的食品添加剂。某兴趣小组用如图所示装罝制备NaNO2并对其性质作如下探究(A中加热装罝已略去)。
查阅资料可知:
① 2NO+Na2O22NaNO2;2NO2+Na2O22NaNO3。
② NO能被酸性KMnO4氧化成![]() 。
。
③ 在酸性条件下,NaNO2能将I氧化为I2;![]() 能将I2还原为I ,即I2+2
能将I2还原为I ,即I2+2![]() 2I+
2I+![]() 。
。
(1)装置中仪器a的名称为 ,A中反应的化学方程式是 。
(2)装置B中观察到的主要现象是 。
(3)装置C中盛放的试剂是 。
(4)装置E的作用是_______________。
(5)A中滴入浓硝酸之前,应先通入N2一段时间,原因是 。
(6)为测定所得NaNO2的纯度,准确称取m g NaNO2样品放入锥形瓶中并加入适量水溶解,再加入过量KI溶液并滴入几滴淀粉溶液,然后滴加稀硫酸,用c mol/L Na2S2O3溶液滴定至终点,重复操作2~3次,平均消耗Na2S2O3 V mL。滴定终点的现象是 。该样品中NaNO2的质量分数为 。
【答案】除标注外,其余每空均2分
(1)三颈烧瓶(1分) C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
(2)溶液变蓝,铜片溶解,有无色气体冒出
(3)碱石灰(或者生石灰)(1分)
(4)吸收有毒的NO气体,防止污染空气
(5)避免装置中的空气与过氧化钠反应导致产品不纯
(6)溶液由蓝色恰好变为无色,且半分钟内不变色(1分) ![]() %(3分)
%(3分)
【解析】
试题分析:
(1)仪器a为三颈烧瓶;烧瓶中浓硝酸与炭在加热时发生氧化还原反应,化学方程式为C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
(2)NO2溶于水,与水发生反应产生NO,3NO2+ H2O2HNO3+ NO,产生的硝酸再与Cu发生反应:3Cu+8HNO3(稀) 2Cu(NO3)2+2NO↑+4H2O。所以B中观察到的主要现象是溶液变蓝,铜片溶解,有无色气体冒出;
(3)进入C装置的气体中除了NO外,还有H2O和CO2,两者都能与过氧化钠反应,从而影响产品的纯度,故必须除去H2O和CO2,试剂是碱石灰或生石灰;
(4)实验中的尾气NO,会污染空气,NO能被酸性KMnO4氧化成![]() ,故E可吸收有毒的NO气体,防止污染空气;
,故E可吸收有毒的NO气体,防止污染空气;
(5)为避免装置中的空气导致产品不纯,需要打开弹簧夹通入氮气排净装置中的空气;
(6)NaNO2将KI氧化为I2,再利用Na2S2O3溶液滴定I2,所以滴定终点的现象是溶液由蓝色恰好变为无色,且半分钟内不变色;在酸性条件下,NaNO2能将I氧化为I2;![]() 能将I2还原为I,即I2+2
能将I2还原为I,即I2+2![]() 2I+
2I+![]() 。可得关系式NaNO2~Na2S2O3,消耗Na2S2O3的物质的量为cV×103mol,则该样品中NaNO2的物质的量也为cV×103mol,样品中NaNO2的质量分数为cV×103×69÷m ×100% =
。可得关系式NaNO2~Na2S2O3,消耗Na2S2O3的物质的量为cV×103mol,则该样品中NaNO2的物质的量也为cV×103mol,样品中NaNO2的质量分数为cV×103×69÷m ×100% =![]() %。
%。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案