题目内容
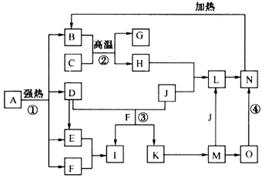
图中B为日常生活中常见的金属,E是一种新型的清洁能源,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是生理盐水主要成分(图中部分反应物或生成物没有列出).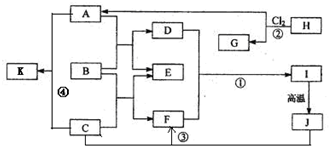
请按要求回答:
(1)写出B在周期表的位置第______周期______族,G的电子式______.
(2)反应①的离子方程式为______.
(3)反应②进行的条件是______,______.
(4)反应③的化学方程式为______.
解:H、G是正四面体结构的非极性分子,H是一种重要的能源,则H为甲烷,由反应②可知G为CCl4,A为HCl;K是生理盐水主要成分,则K为NaCl,由反应④可知C为NaOH;B为金属,能与盐酸、与氢氧化钠反应,则B为Al,由框图中的转化可知E为氢气,D为氯化铝,F为偏铝酸钠,I为氢氧化铝,J为氧化铝;
(1)因B为铝,位于周期表中第三周期第ⅢA族,G为CCl4,其电子式为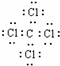 ,故答案为:三;ⅢA;
,故答案为:三;ⅢA;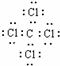 ;
;
(2)D为氯化铝,F为偏铝酸钠,则反应①的离子反应为Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(3)因烷烃的取代反应在光照条件下进行,为保证甲烷完全反应,则氯气应过量,故答案为:光照;过量Cl2;
(4)J为氧化铝,C为NaOH,则反应③的离子方程式为Al2O3+2NaOH═2NaAlO2+H2O,故答案为:Al2O3+2NaOH═2NaAlO2+H2O.
分析:H、G是正四面体结构的非极性分子,H是一种重要的能源,则H为甲烷,由反应②可知G为CCl4,A为HCl;K是生理盐水主要成分,则K为NaCl,由反应④可知C为NaOH;B为金属,能与盐酸、与氢氧化钠反应,则B为Al,由框图中的转化可知E为氢气,D为氯化铝,F为偏铝酸钠,I为氢氧化铝,J为氧化铝;然后可依次解答各小问.
点评:本题考查无机物的推断,明确推断中转化的关系及物质的性质即可解答,明确推断突破口为H、K及B既能与酸反应又能与碱反应是解答本题的关键.
(1)因B为铝,位于周期表中第三周期第ⅢA族,G为CCl4,其电子式为
 ,故答案为:三;ⅢA;
,故答案为:三;ⅢA; ;
;(2)D为氯化铝,F为偏铝酸钠,则反应①的离子反应为Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(3)因烷烃的取代反应在光照条件下进行,为保证甲烷完全反应,则氯气应过量,故答案为:光照;过量Cl2;
(4)J为氧化铝,C为NaOH,则反应③的离子方程式为Al2O3+2NaOH═2NaAlO2+H2O,故答案为:Al2O3+2NaOH═2NaAlO2+H2O.
分析:H、G是正四面体结构的非极性分子,H是一种重要的能源,则H为甲烷,由反应②可知G为CCl4,A为HCl;K是生理盐水主要成分,则K为NaCl,由反应④可知C为NaOH;B为金属,能与盐酸、与氢氧化钠反应,则B为Al,由框图中的转化可知E为氢气,D为氯化铝,F为偏铝酸钠,I为氢氧化铝,J为氧化铝;然后可依次解答各小问.
点评:本题考查无机物的推断,明确推断中转化的关系及物质的性质即可解答,明确推断突破口为H、K及B既能与酸反应又能与碱反应是解答本题的关键.

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目