题目内容
(2008?枣庄一模)学习元素周期律后,某研究性学习小组的同学们对第四周期过渡元素的氧化物产生了浓厚的兴趣.在已知二氧化锰对氯酸钾催化分解知识的基础上,联想到氧化铁、氧化铜、氧化铬等对氯酸钾的分解是否有催化作用,对此他们进行了实验研究.
请根据要求完成下列部分实验报告:
(1)课题名称:
(2)实验仪器及试剂:
实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
(3)实验步骤:略
(4)实验数据:
(5)实验讨论:
①在氧化物的回放过程中,要进行的操作是溶解、
②实验编号3的实验中KClO3的分解率为
③在和Cr2O3做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色.该刺激性气味的气体是
(6)实验结论
请根据要求完成下列部分实验报告:
(1)课题名称:
探究氧化铁、氧化铜、氧化铬等对氯酸钾分配是否有催化作用
探究氧化铁、氧化铜、氧化铬等对氯酸钾分配是否有催化作用
.(2)实验仪器及试剂:
实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、
试管、酒精灯、秒表
试管、酒精灯、秒表
等.实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
(3)实验步骤:略
(4)实验数据:
| 实验 编号 |
KClO3/g | 氧化物 | 产生气体/mL (已折算到标况) |
耗时/s | ||
| 化学式 | 质量/g | 回收 | ||||
| 1 | 0.60 | - | - | - | 10 | 480 |
| 2 | 0.60 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.60 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.60 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| 5 | 0.60 | Cr2O3 | 0.20 | 90% | 67.2 | 188.3 |
①在氧化物的回放过程中,要进行的操作是溶解、
过滤
过滤
、洗涤、干燥
干燥
、称量.②实验编号3的实验中KClO3的分解率为
40.8
40.8
(保留一位小数).③在和Cr2O3做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色.该刺激性气味的气体是
C12
C12
,可用湿润的KI淀粉
湿润的KI淀粉
试纸检验.上述异常现象产生的原因是Cr2O3与KC1O3发生氧化还原反应
Cr2O3与KC1O3发生氧化还原反应
.(6)实验结论
Fe2O3、CuO能对KC1O(3分)解起催化作用
Fe2O3、CuO能对KC1O(3分)解起催化作用
.分析:(1)本实验的目的是探究CuO、Fe2O3、Cr2O3等对氯酸钾的受热分解有没有催化作用,根据课题目的确定实验名称;
(2)试根据实验要测定时间,所以应有秒表,还有反应容器和加热仪器;
(5)①CuO、Fe2O3、Cr2O3都难溶于水,所以回收是要溶解、洗涤、过滤、干燥、称量;
②先根据n=
计算氧气的物质的量,再根据氯酸钾和氧气的关系式计算氯酸钾的物质的量,根据m=nM计算反应的氯酸钾的质量,再计算分解的氯酸钾与加入的氯酸钾的质量之比即可;
③根据元素守恒及题意判断生成物,氯气有氧化性,能使湿润的淀粉碘化钾变蓝;
(6)根据图表中回收的氧化物及耗时与二氧化锰作比较分析.
(2)试根据实验要测定时间,所以应有秒表,还有反应容器和加热仪器;
(5)①CuO、Fe2O3、Cr2O3都难溶于水,所以回收是要溶解、洗涤、过滤、干燥、称量;
②先根据n=
| V |
| Vm |
③根据元素守恒及题意判断生成物,氯气有氧化性,能使湿润的淀粉碘化钾变蓝;
(6)根据图表中回收的氧化物及耗时与二氧化锰作比较分析.
解答:解:(1)本实验的目的是探究CuO、Fe2O3、Cr2O3等对氯酸钾的受热分解有没有催化作用,所以其课题名称为探究CuO、Fe2O3、Cr2O3等对氯酸钾的受热分解反应的催化作用.
故答案为:探究氧化铁、氧化铜、氧化铬等对氯酸钾分配是否有催化作用;
(2)试根据实验要测定时间,所以应有秒表,还有反应容器和加热仪器,故答案为:试管、酒精灯、秒表;
(5)①CuO、Fe2O3、Cr2O3都难溶于水,所以回收是要溶解、洗涤、过滤、干燥、称量,
故答案为:过滤、干燥;
②生成氧气的物质的量为n=
=
=0.003mol,
2KCl3
2KCl+3O2↑
2mol 3mol
0.002mol 0.003mol
所以反应的氯酸钾的物质的量为 0.002mol,质量为m=nM=0.002mol×122.5g/mol=0.245g,
所以其分解率为
×100%=40.8%,
故答案为:40.8%;
③用Cr2O3做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色,则Cr元素的化合价升高,Cl元素的化合价降低,氯酸钾与氧化铬发生了氧化还原反应,生成氯气,其化学式为Cl2,氯气能使湿润的淀粉碘化钾试纸变蓝,则可以使用湿润的淀粉碘化钾试纸检验氯气,
故答案为:Cl2;湿润的淀粉碘化钾;KClO3与Cr2O3发生了氧化还原反应;
(6)根据图表中回收的氧化物及耗时分析,CuO、Cr2O3 与二氧化锰比较,耗时较长且Cr2O3 的回收物有异常,氯化铁和二氧化锰的催化能力相近.
故答案为:Fe2O3、CuO能对KC1O分解起催化作用.
故答案为:探究氧化铁、氧化铜、氧化铬等对氯酸钾分配是否有催化作用;
(2)试根据实验要测定时间,所以应有秒表,还有反应容器和加热仪器,故答案为:试管、酒精灯、秒表;
(5)①CuO、Fe2O3、Cr2O3都难溶于水,所以回收是要溶解、洗涤、过滤、干燥、称量,
故答案为:过滤、干燥;
②生成氧气的物质的量为n=
| V |
| Vm |
| 0.0672L |
| 22.4L/mol |
2KCl3
| ||
| △ |
2mol 3mol
0.002mol 0.003mol
所以反应的氯酸钾的物质的量为 0.002mol,质量为m=nM=0.002mol×122.5g/mol=0.245g,
所以其分解率为
| 0.245g |
| 0.6g |
故答案为:40.8%;
③用Cr2O3做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色,则Cr元素的化合价升高,Cl元素的化合价降低,氯酸钾与氧化铬发生了氧化还原反应,生成氯气,其化学式为Cl2,氯气能使湿润的淀粉碘化钾试纸变蓝,则可以使用湿润的淀粉碘化钾试纸检验氯气,
故答案为:Cl2;湿润的淀粉碘化钾;KClO3与Cr2O3发生了氧化还原反应;
(6)根据图表中回收的氧化物及耗时分析,CuO、Cr2O3 与二氧化锰比较,耗时较长且Cr2O3 的回收物有异常,氯化铁和二氧化锰的催化能力相近.
故答案为:Fe2O3、CuO能对KC1O分解起催化作用.
点评:本题考查化学反应速率影响的因素,探究催化剂对化学反应速率的影响及催化效果,注意实验过程及实验现象、结论,能够较好的考查学生综合应用知识的能力.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
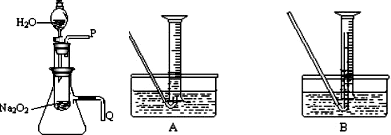 (2008?枣庄一模)化学课上老师做了一个演示实验:用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.
(2008?枣庄一模)化学课上老师做了一个演示实验:用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.