题目内容
【题目】实验室里用二氧化锰和浓盐酸加热制取氯气;
(1)该反应的离子方程式为____________________________。
根据反应原理,图乙中合适的气体发生装置为 ______ 。
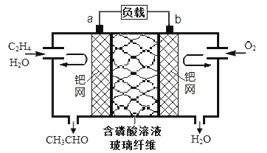
(2)也可以利用反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O制取并收集纯净、干燥的氯气,部分装置如图甲所示。
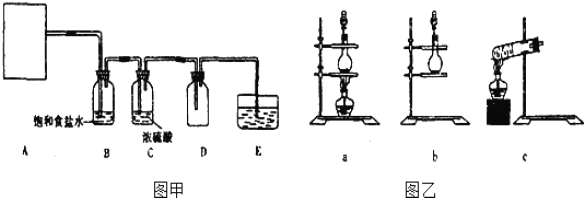
根据反应原理,图乙中合适的制气装置为 ______ 。
(3)装置B的作用是 ______ 。
(4)装置E的作用是 ______,E中的试剂可选 ______ 。
A.NaOH溶液 B.NaCl溶液 C.澄清石灰水 D.水
(5)某同学通过下列两种方式制取氯气:
①用8.7g MnO2与足量浓盐酸反应;
②用含14.6g HCl的浓盐酸与足量MnO2反应这两种方式产生Cl2的量的关系是 ______。
A.①多 B.②多 C.一样多 D.不确定.
【答案】 MnO2+4H+ +2Cl - ![]() Mn2++Cl2↑+2H2O a b 除去氯气中的氯化氢 吸收多余的氯气,防止污染空气 A A
Mn2++Cl2↑+2H2O a b 除去氯气中的氯化氢 吸收多余的氯气,防止污染空气 A A
【解析】(1)实验室制备氯气的离子方程式为MnO2+4H+ +2Cl - ![]() Mn2++Cl2↑+2H2O。该反应需要加热,属于固体和液体的反应,选择装置a;(2)也可以利用反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O制取并收集纯净、干燥的氯气,由于该反应不需要加热,属于固体和液体之间的反应,因此选择装置b;(3)盐酸易挥发,生成的氯气中含有氯化氢,因此装置B中饱和食盐水的作用是除去氯气中的氯化氢。(4)氯气有毒,需要尾气处理,则装置E的作用是吸收多余的氯气,防止污染空气,E中的试剂可选用碱液,由于澄清石灰水的浓度较小,不利于吸收氯气,因此选择氢氧化钠溶液,答案选A。(5)依据方程式可知
Mn2++Cl2↑+2H2O。该反应需要加热,属于固体和液体的反应,选择装置a;(2)也可以利用反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O制取并收集纯净、干燥的氯气,由于该反应不需要加热,属于固体和液体之间的反应,因此选择装置b;(3)盐酸易挥发,生成的氯气中含有氯化氢,因此装置B中饱和食盐水的作用是除去氯气中的氯化氢。(4)氯气有毒,需要尾气处理,则装置E的作用是吸收多余的氯气,防止污染空气,E中的试剂可选用碱液,由于澄清石灰水的浓度较小,不利于吸收氯气,因此选择氢氧化钠溶液,答案选A。(5)依据方程式可知
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
87g 146g 1mol
8.7g 14.6g 0.1mol
若①用8.7g MnO2与足量浓盐酸反应制取Cl2,则生成氯气的物质的量为0.1mol;②用含14.6g HCl的浓盐酸与足量MnO2反应制取Cl2,因为随着反应进行盐酸浓度降低,变为稀盐酸,所以14.6g氯化氢不能完全反应,所以生成的氯气的物质的量小于0.1mol;答案选A。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案