题目内容
(6分)实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCI(浓)  MnCl2+C12↑+2H2O
MnCl2+C12↑+2H2O
取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为6.72L。
请回答下列问题:
(1)参加反应的二氧化锰的质量为 。
(2)参加反应的HCl的物质的量为 。
(3)实验室备用的浓盐酸质量分数为36.5%,密度为1.19g·cm-3,
为使用方便,请计算出该浓盐酸的物质的量浓度: 。
 MnCl2+C12↑+2H2O
MnCl2+C12↑+2H2O取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为6.72L。
请回答下列问题:
(1)参加反应的二氧化锰的质量为 。
(2)参加反应的HCl的物质的量为 。
(3)实验室备用的浓盐酸质量分数为36.5%,密度为1.19g·cm-3,
为使用方便,请计算出该浓盐酸的物质的量浓度: 。
(6分)(1)26.1g (2)1.2mol (3)11.9 mol·L-1(每空2分)
考查物质的量有关计算及根据方程式进行的有关计算。
(1)标准状况下,6.72L氯气的物质的量是6.72L÷22.4L/mol=0.3mol
反应的方程式是
MnO2+4HCI(浓) MnCl2+C12↑+2H2O
MnCl2+C12↑+2H2O
1mol 4mol 1mol
0.3mol
所以参加反应的二氧化锰的物质的量是0.3mol
质量是0.3mol×87g/mol=26.1g
(2)根据反应的方程式可知,参加反应的HCl的物质的量为0.3mol×4=1.2mol
(3)根据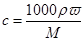 可知,该浓盐酸的物质的量浓度是
可知,该浓盐酸的物质的量浓度是
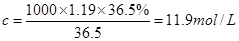 。
。
(1)标准状况下,6.72L氯气的物质的量是6.72L÷22.4L/mol=0.3mol
反应的方程式是
MnO2+4HCI(浓)
 MnCl2+C12↑+2H2O
MnCl2+C12↑+2H2O1mol 4mol 1mol
0.3mol
所以参加反应的二氧化锰的物质的量是0.3mol
质量是0.3mol×87g/mol=26.1g
(2)根据反应的方程式可知,参加反应的HCl的物质的量为0.3mol×4=1.2mol
(3)根据
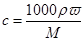 可知,该浓盐酸的物质的量浓度是
可知,该浓盐酸的物质的量浓度是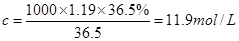 。
。
练习册系列答案
相关题目