题目内容
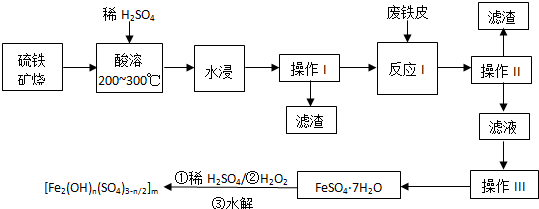
7.交警常用“司机饮酒检测仪”检查司机是否酒后驾车,其原理是硫酸酸化的重铬酸盐(Cr2O72-橙红色)和乙醇反应生成铬盐(Cr3+绿色),和乙酸等.重铬酸钠(Na2Cr2O7)在工业中有很广泛的应用,常用来制备金属铬.方法如下:将铬铁矿[主要成分为Fe(CrO2)2]与纯碱、氧气高温焙烧,除杂、酸化,得到重铬酸钠,碳和重铬酸钠高温生成Cr2O3、Na2CO3和CO,Cr2O3再经铝热法还原,即可制得金属铬.
请回答:
(1)硫酸酸化的K2Cr2O7和乙醇反应的化学方程式是2K2Cr2O7+3CH3CH2OH+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O.
(2)写出碳和重铬酸钠高温反应的化学方程式Na2Cr2O7)+2C$\frac{\underline{\;高温\;}}{\;}$Cr2O3+Na2CO3+CO↑;Cr2O3经铝热法还原制得金属铬的化学方程式是Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Cr+Al2O3 .
(3)硫酸酸化的Na2Cr2O7和FeSO4反应,生成Cr3+等,该反应的离子方程式是Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O.
(4)某Na2Cr2O7样品2.00g恰好和4.56g FeSO4完全反应.该样品的纯度为65.5%.
分析 (1)由于K2Cr2O7在酸性条件下有很强的氧化性,而乙醇具有还原性,能够被氧化成CH3COOH;
(2)由题意可知碳和重铬酸钠在高温下反应生成Cr2O3、Na2CO3和CO,结合反应中氧化剂和还原剂得失电子守恒,原子个数守恒配平方程式;三氧化二铬与铝在高温条件下发生置换反应生成铬与三氧化二铝;
(3)Na2Cr2O7和在酸性环境下具有强的氧化性,能够将亚铁离子氧化成三价铁离子,本身被还原生成三价铬离子;
(4)依据方程式Na2Cr2O7+6FeSO4+7H2SO4=Cr2(SO4)3+3Fe2(SO4)3+7H2O+Na2SO4计算解答.
解答 解:(1)硫酸酸化的K2Cr2O7和乙醇反应的化学方程式为:2K2Cr2O7+3CH3CH2OH+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O;
故答案为:2K2Cr2O7+3CH3CH2OH+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O;
(2)碳和重铬酸钠高温反应的化学方程式为:Na2Cr2O7)+2C$\frac{\underline{\;高温\;}}{\;}$Cr2O3+Na2CO3+CO↑;三氧化二铬与铝发生铝热反应的方程式为:Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Cr+Al2O3;
故答案为:Na2Cr2O7)+2C$\frac{\underline{\;高温\;}}{\;}$Cr2O3+Na2CO3+CO↑;Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Cr+Al2O3 ;
(3)Na2Cr2O7和在酸性环境下与FeSO4反应的离子方程式:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(5)Na2Cr2O7+6FeSO4+7H2SO4=Cr2(SO4)3+3Fe2(SO4)3+7H2O+Na2SO4
262 6×152
m 4.56g
则m=1.31g;
Na2Cr2O7样品的百分含量:$\frac{1.31g}{2.00g}$×100%=65.5%;
故答案为:65.5%.
点评 本题主要考查了氧化还原反应,涉及氧化还原方程式的书写及有关化学方程式的计算,题目难度较大,掌握氧化还原方程式配平方法.

 阅读快车系列答案
阅读快车系列答案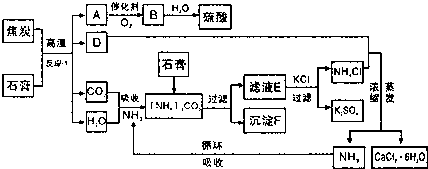
请回答下列问题:
(1)反应①的化学方程式是CaSO4•2H2O+C$\frac{\underline{\;高温\;}}{\;}$2CaO+2SO2↑+CO2↑+4H2O↑;
(2)沉淀F含有CaCO3和CaSO4•2H2O(填化学式)等物质,可作为生产水泥的主要原料;
(3)检验滤液E中含有CO2-3的方法是取少许滤液滴加到盐酸中产生气泡(用简要文字回答);
(4)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,主要选择的依据是cd(填序号)
a.能导电 b.易溶于水 c.熔点较低(29℃熔化) d.无毒
(5)工业制硫酸的精制炉气中,SO2平衡转化率与温度及压强关系如下表:
| 压强/MPa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
| A. | NaI | B. | NaHSO4 | C. | CH3COONH4 | D. | KF |
| A. | H2SO4+Ba(OH)2═BaSO4↓+2H2O | B. | NaOH+HNO3═NaNO3+H2O | ||
| C. | NaOH+NaHCO3═Na2CO3+H2O | D. | Mg(OH)2+2HCl═MgCl2+2H2O |
| A. | 在豆浆中加入盐卤做豆腐 | |
| B. | 三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 | |
| C. | 在河流入海口出易形成沙洲 | |
| D. | 过滤除去氯化钠溶液中的泥沙 |
 学科研小组现对此味精中NaCl的含量进行测定。
学科研小组现对此味精中NaCl的含量进行测定。 测定。该小组同学设计的实验方案如
测定。该小组同学设计的实验方案如 图所示:
图所示: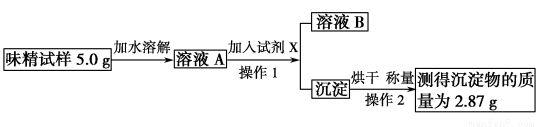
 ____________;
____________;