题目内容
已知热化学方程式2SO2(g)+ O2(g)  2 SO3(g) △H=-Q
kJ·mol-1(Q>0),则下列说法正确的是
2 SO3(g) △H=-Q
kJ·mol-1(Q>0),则下列说法正确的是
A.单位时间内生成2molSO2,同时生成1molO2,说明反应达到平衡状态
B.将2molSO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量
C.升高温度,正反应速率增大,逆反应速率减小,上述热化学方程式中的Q值减小
D.上述热化学反应方程式说明反应物的总键能小于生成物的总键能
【答案】
D
【解析】A:单位时间内生成2molSO2,同时生成1molO2,皆表示得是逆反应速率,不能判断是否平衡;B:可逆反应不可能进行到底,将2molSO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出热量小于Q kJ ;C:升温,正逆反应速率均增大,平衡逆向移动,但Q值不会改变;D:当反应物的总键能小于生成物的总键能时,打开旧键吸热少,生成新键放热多,与题意相符。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
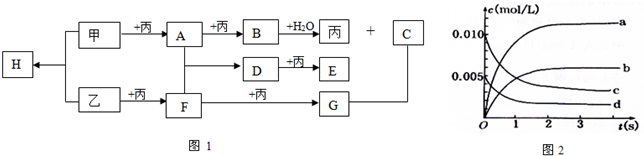
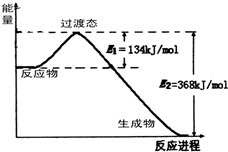 能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料. 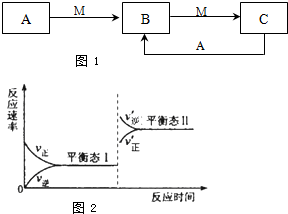 物质A、B、C有如图1转化关系:
物质A、B、C有如图1转化关系: