题目内容
【题目】氯化亚铁具有独有的脱色能力,适用于染料、染料中间体、印染、造纸行业的污水处理。某课题小组设计如下方案制备氯化亚铁并探究氯化亚铁(Fe2+)的还原性。
某同学选择下列装置用氯化铁制备少量氯化亚铁(装置不可以重复使用)。
查阅资料知:氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2和HCl。
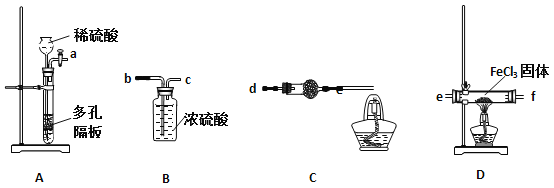
(1)实验开始前应先检查装置的气密性,请叙述装置A气密性检验的方法: 。
(2)气流从左至右,装置接口连接顺序是:
a→ ( )→( )→( )→( )→( )
(3)装置C中干燥管中所盛试剂为碱石灰,其作用是: 、
用上述方法制得的氯化亚铁中可能含有氯化铁,某同学设计了如下实验,测定样品中铁元素的质量分数x.请按要求回答下列问题:
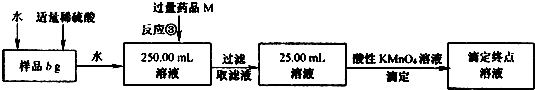
(4)反应③的离子方程式为__ ___.
(5)若3次平行滴定实验,平均消耗c mol/L KMnO4溶液的体积为d mL,则样品中铁元素的质量分数(化简代数式)x=_____________;若样品溶解仍使用盐酸而不改用稀硫酸,则所得样品中铁元素的质量分数将(填“偏大”、“偏小”或“无影响”)____ _________.
【答案】(14分)
(1)关闭活塞,向长颈漏斗内注水至形成一段水柱且液面高度不变,说明装置气密性良好
(2)b c e f d
(3)碱石灰或生石灰(1分) 除去HCl、并防止空气中不的进入
(5)2Fe3++Cu=2Fe2++Cu2+
(6)![]() 偏大(1分)
偏大(1分)
【解析】
试题分析:(1)装置气密性的检验,利用长颈漏斗检验使用注水法,加入水形成一段水柱且保持不变,关闭活塞,向长颈漏斗内注水至形成一段水柱且液面高度不变,说明装置气密性良好;
(2)装置的连接顺序是利用装置A生成氢气通过浓硫酸干燥后通入装置D中的玻璃管中加热反应,在加热条件下氢气还原氯化铁生成FeCl2和HCl,剩余氢气通过装置C点燃处理,气流从左至右,装置接口连接顺序是a b c e f d;
(3)装置C中碱石灰或生石灰吸收生成的氯化氢,故C中干燥管应盛放碱石灰作用除去HCl、并防止空气中水的进入;
(4)反应③是加入M把铁离子还原为亚铁离子,最后用高锰酸钾氧化滴定测定亚铁离子的物质的量计算含量,加入的M为铜,反应的离子方程式是2Fe3++Cu=2Fe2++Cu2+;
(5)若3次平行滴定实验,平均消耗c mol/L KMnO4溶液的体积为d mL,物质的量为cmol/L×d×10-3L;依据反应的离子方程式,设亚铁离子物质的量为x:
5Fe2++MnO4-+16H+=Mn2++5Fe3++8H2O
5 1
x cd×10-3mol
x=5 cd×10-3mol
250ml溶液中含铁元素物质的量为5 cd×10-2mol
样品中铁元素的质量分数=![]() ×100%=
×100%=![]() ;
;
若样品溶解仍使用盐酸而不改用稀硫酸,氯离子被高锰酸钾氧化,消耗高锰酸钾物质的量增大,则所得样品中铁元素的质量分数将偏大;

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案