题目内容
已知:
(1)PH=2的次碘酸(HIO)溶液与PH=12的NaOH溶液等体积混合,所得溶液呈酸性;
(2)0.01mol/L的HIO3或HMnO4溶液与PH=12的Ba(OH)2溶液等体积混合所得溶液均呈中性。
则下列有关结论不正确的是
(1)PH=2的次碘酸(HIO)溶液与PH=12的NaOH溶液等体积混合,所得溶液呈酸性;
(2)0.01mol/L的HIO3或HMnO4溶液与PH=12的Ba(OH)2溶液等体积混合所得溶液均呈中性。
则下列有关结论不正确的是
[ ]
A、HIO是强酸
B、HIO3是强酸
C、HMnO4是强电解质
D、HIO是弱酸
B、HIO3是强酸
C、HMnO4是强电解质
D、HIO是弱酸
A

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
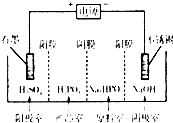
 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下: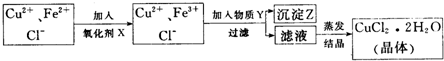
 已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3.
已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3.